
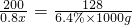

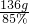 =160g
=160g  %,找到已知量和未知量.
%,找到已知量和未知量.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:2CaCO3(粉末) + 2SO2+ O2====2CaSO4+ 2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)的石灰石__________克。
(2)处理上述100克废气,可得到含CaSO4 85%的粗产品_________克。
查看答案和解析>>
科目:初中化学 来源:2008年上海市徐汇区中考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com