
【题目】氢气是理想的清洁高能燃料,生产氢气的方法有多种。
(1)方法Ⅰ:电解水法。电解水的符号表达式为_________,反应的基本类型是_____。
(2)方法Ⅱ:光解水法。我国科学家已研制出在新型高效光催化剂作用下,利用太阳能分解水制氢气。水分解过程中,不能再分的粒子是______(填具体粒子名称)。光解水法与电解水法相比最显著的优点是_____________。
(3)方法III:工业上可用煅烧黄铁矿(主要成分FeS2)产生的二氧化硫,通过下列工艺过程制取氢气。
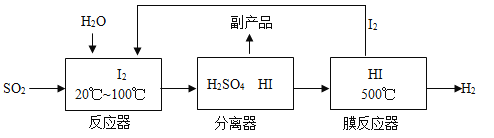
①写出膜反应器中HI气体发生分解反应的符号表达式_____________。
②流程中能被循环利用的物是_______。
③物质所含元素化合价发生变化的反应称为氧化还原反应。反应器中发生的反应________(填“属于”或“不属于”)氧化还原反应。
【答案】![]() 分解反应 氢原子和氧原子 节约能源
分解反应 氢原子和氧原子 节约能源 ![]()
![]() 属于
属于
【解析】
生产氢气的方法有多种。
(1)方法Ⅰ:电解水法。电解水生成氢气和氧气,反应的符号表达式为![]() ,反应的基本类型是分解反应。
,反应的基本类型是分解反应。
(2)方法Ⅱ:光解水法。在新型高效光催化剂作用下,利用太阳能分解水制氢气。水分解过程中,水分子变成氢原子和氧原子,氢原子和氧原子重新组合成氢分子和氧分子,该过程中不能再分的粒子是氢原子和氧原子。光解水法与电解水法相比最显著的优点是节约能源。
(3)方法III:工业上可用煅烧黄铁矿(主要成分FeS2)产生的二氧化硫,制取氢气。
①根据流程图可知膜反应器中HI气体分解生成氢气和碘单质,反应的符号表达式为![]() 。
。
②根据流程图可知流程中能被循环利用的物是![]() 。
。
③物质所含元素化合价发生变化的反应称为氧化还原反应。反应器中![]() 变成
变成![]() ,碘元素化合价由0价降低到-1价,
,碘元素化合价由0价降低到-1价,![]() 变成
变成![]() ,硫元素化合价由+4价升高到+6价,因此反应器中发生的反应属于氧化还原反应。
,硫元素化合价由+4价升高到+6价,因此反应器中发生的反应属于氧化还原反应。


科目:初中化学 来源: 题型:
【题目】课题小组为测定某黄铜(铜与锌合金)样品中铜的含量,取20g黄铜样品放在烧杯中,然后向其中分5次注入100g一定浓度的稀盐酸,使之与样品充分反应(杂质不参与反应)。随反应进行,注入稀盐酸的质量与反应剩余固体的质量如下表所示关系。请计算产生氢气的质量___________。(结果保留小数点后一位)
加稀盐酸的次数 | 1 | 2 | 3 | 4 | 5 |
加稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 16.75 | 13.5 | 10.25 | 7 | 7 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体(FeSO4·7H2O),设计了如下实验方案,请回答下列问题:
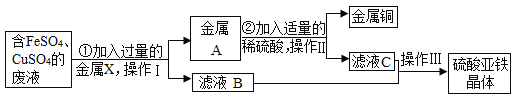
(1)操作Ⅰ、Ⅱ都为________;
(2)步骤①中,金属X是________,该反应的化学方程式为______;
(3)步骤②中,加稀硫酸的目的是_______。该反应的化学方程式为____;
(4)滤液B、C中的溶质是__________;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?

I.小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。

(1)请写出过氧化氢分解的反应方程式:______________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到__________,说明生成的气体是氧气。
II.小林查阅了相关资料,并进行了探究实验
(查阅资料)
(1)过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | _____ |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液 第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是___________。
(4)实验②中第一次收集到的氧气体积为__________ mL。
(5)实验②中横线部分应进行的操作是__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/ ℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/ mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是氧气化学性质的部分知识网络,请回答下列问题。

(1)Ⅰ、Ⅱ两类反应均属于氧化反应,氧气在氧化反应中提供氧,具有______性。
(2)加热高锰酸钾制取氧气的符号表达式为___________。一氧化碳(CO)在空气中燃烧生成二氧化碳,反应的符号表达式为___________,基本类型是________。
(3)做铁丝燃烧实验时,预先在集气瓶里加少量水的目的是____________,铁在氧气中燃烧的符号表达式为______________。
(4)图中涉及部分相关物质有:①硫粉;②一氧化碳;③葡萄糖(C6H12O6);④二氧化硫;⑤液氧;⑥食用醋。其中属于混合物的是_____(填序号),属于单质的是_____(填化学式),属于氧化物的是_______(填化学式)。
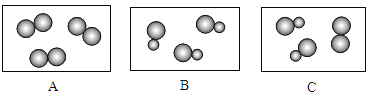
(5)下图表示气体分子示意模型,其中属于化合物的是_____(填字母),属于混合物的是_____(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室开放日,某化学兴趣小组的同学在老师的指导下,设计了如下实验装置进行气体制取和性质的探究,请回答有关问题:
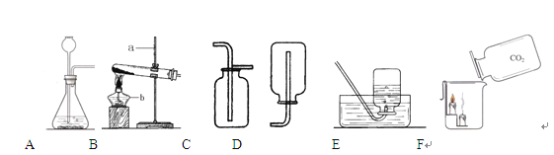
(1)请写出图中标有字母的仪器名称: a b
(2)实验室用氯酸钾和二氧化锰混合制取氧气时,应选用的发生装置是 (填写装置的字母代号,下同),请写出该反应的化学方程式: ,其中二氧化锰起 作用。
(3)实验室制取二氧化碳气体时,应选择的发生装置和收集装置是 。
(4)如图F所示,向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的性质是 、 ,且密度比空气的大,因此,二氧化碳可用于 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体的一些装置,据图回答问题。(以下所选装置均填装置序号)
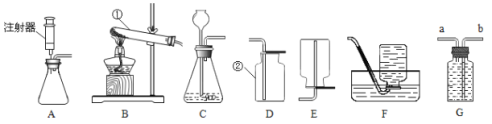
(1)写出指定仪器的名称:①_____,②_____。
(2)实验室要用C装置作氧气的发生装置,应先在锥形瓶里放入的物质是_____。
(3)若实验室要用高锰酸钾为原料用装置B制取氧气,则对该装置做的一点改进是_____,该反应的符号表达式为:_____;该装置中试管口略向下倾斜的原因是:_____,要收集一瓶干燥的氧气,应选择的收集装置是_____(填字母)。
(4)用F装置收集氧气的优点是_____。
(5)制取气体前应先检查装置气密性,若按如图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是_____(填序号)。

a 将水换成冰水 b 将烧杯换成水槽 c 导管伸入水中位置过深,气体无法逸出 d 先用手捂住试管壁,再将导管另一端插入水中
(6)实验室在常温下用块状固体电石与水反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是_____;已知乙炔是一种难溶于水的气体,可以选择的收集装置是_____,如果用装置G收集乙炔,气体应从_____(填“a”或“b”)端管口通人。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N )就是其中的一种。请回答下列问题:
(1)丙氨酸由___________种元素组成,其分子共有___个原子,
(2)计算丙氨酸的相对分子质量________
(3)计算丙氨酸中氮元素的质量分数________(精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com