
 碘元素对人体健康起着重要的作用.碘酸钾(KIO3)是食盐中主要的加碘剂.
碘元素对人体健康起着重要的作用.碘酸钾(KIO3)是食盐中主要的加碘剂.| H2O2,酸 |
| 70℃ |
| K2CO3 |
| 该元素的相对原子质量×原子个数 |
| 物质的相对分子质量 |
| 该元素的相对原子质量×原子个数 |
| 物质的相对分子质量 |
| 127 |
| 39+127+16×3 |
| 15 |
| 59.3% |
| 30 |
| 59.3% |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:
| A、K2SO4 K2SO3 K2S |
| B、H2S S SO2 SO3 |
| C、H2S H2SO4 H2SO3 |
| D、Na2SO4 Na2S Na2SO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
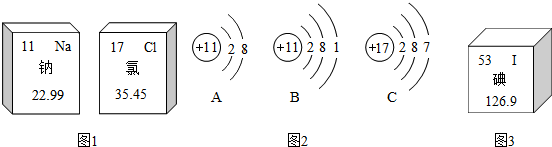
| 质子数 | 中子数 | 相对原子质量(近似取整) | |
| I-127 | m | 74 | 127 |
| I-131 | 53 | n | 131 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某市售天然矿泉水标签的部分内容如图所示. 请仔细阅读并回答下列问题.
某市售天然矿泉水标签的部分内容如图所示. 请仔细阅读并回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:
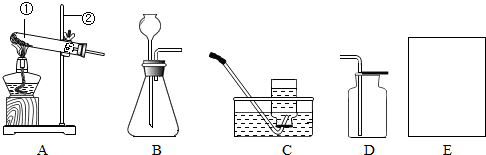
 (填序号,如果没有合适选项请选E并在方框中画出合适的装置).
(填序号,如果没有合适选项请选E并在方框中画出合适的装置).查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 项目 | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
| 水溶性 | 易溶,在15℃时溶解度为81.5g | 易溶,在15℃时溶解度为35.8g |
| 熔 点 | 271℃ | 801℃ |
| 沸 点 | 320℃会分解,放出有刺鼻气味的气体 | 1413℃ |
| 跟稀盐酸作用 | 放出红棕色的气体NO2 | 无反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com