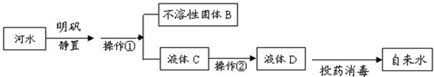
解:(1)操作①后混合物被分离成固体和液体,则该操作为过滤;在过滤后的水中仍然含有可溶性的有色、有异味的物质,通常用吸附剂来吸附,操作②为吸附,除去水中可溶性的有色、有异味的物质,得到液体D,液体D中含有可溶性的钙、镁化合物所以为混合物;
(2)单质中元素的化合价为零,可知Cl
2 中氯元素的化合价为0,
根据化合物里正负化合价代数和为零,设ClO
2中氯元素的化合价为x,Ca(ClO)
2 中氯元素的化合价为y
x+(-2)×2=0,可得 x=+4,
+2+y×2+(-2)×2=0,解之得n=+1,
所以ClO
2中氯元素的化合价为+4,Ca(ClO)
2中氯元素的化合价为+1;
(3)I、结合模型图,根据反应前后原子种类和个数不变,甲构成的物质有2个钠原子、2个氯原子、4个氧原子,质量比为:Na:Cl:O=(23×2):(35.5×2):(16×4)=46:71:64;
Ⅱ、A、分子是化学变化中的最小粒子,分子在化学变化中可以再分,而原子不能再分,故A正确;
B、反应前后分子的个数和种类发生变化,原子的个数和种类不变,故B错误;
C、甲、乙、丙、丁中丁由两种元素组成,其中一种为氧元素,属于氧化物,故C错误;
D、乙物质为氧气是由由分子构成,丙物质为氯化钠由离子构成,故D正确;
E、1个Cl
2分子中共有17×2=34个质子,故E错误.
故答案为:(1)过滤;混合物;
(2)
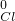 2
2;
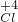
O
2;Ca(

O)
2;
(3)46:71:64;AD.
分析:(1)常见的净化水的方法按照净化程度由低到高的顺序是沉降、过滤、吸附、蒸馏等流程;根据操作推断液体D的种类;
(2)在化合物里正负化合价代数和为零进行分析解答;
(3)I、结合模型图可推测甲组成物质的组成,求出各元素的质量比;
Ⅱ、化学反应中,分子变化,原子不变,氧化物由两种元素组成,其中一种为氧元素的纯净物.
点评:本题考查水的净化、利用化合物的化学式可计算其中未知的元素化合价、解微粒观点及模型图的应用;掌握原子的有关数量计算;掌握元素质量比的计算.

 表示氯原子,
表示氯原子, 表示钠原子,
表示钠原子, 表示氧原子)
表示氧原子)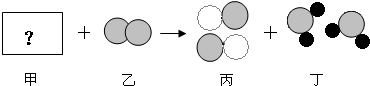
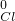 2;
2;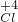 O2;Ca(
O2;Ca( O)2;
O)2;

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案




 表示氯原子,
表示氯原子, 表示钠原子,
表示钠原子, 表示氧原子)
表示氧原子)