
【题目】铝及化合物有极其重要的用途。
(一)铝的广泛应用
(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是_________。使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指________。
A. 单质 B. 元素 C. 原子 D. 分子
(2)氢能源是最理想的能源,科学家研发出一种以“铝镓合金”和水为原料制取氢气的新工艺。“铝镓合金”它属于________(选填序号)。
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(3)实验室可用铝片与稀盐酸反应制备氢气,写出该反应的化学方程式:_________。
(二)硫酸铝铵晶体制取的探究
硫酸铝铵是一种用途广泛的含铝化合物。以某铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3杂质)为原料制硫酸铝铵晶体【(NH4)aAlb(SO4)c·xH2O】的流程如下:
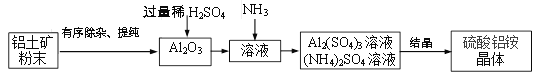
(4)铝土矿粉碎的目的是__________。
(5)有关上述流程的说法正确的是_________。
a.“有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2
b. 稀硫酸过量的目的只是保证Al2O3溶解完全
(三)硫酸铝铵晶体分解的定性探究
硫酸铝铵热分解可得到纳米氧化铝。兴趣小组在科研人员指导下,设计实验探究硫酸铝铵晶体受热分解的产物。
(6)甲组同学设计了如图1所示实验装置:
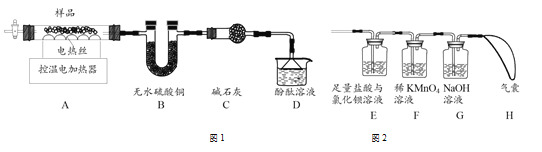
①实验中,装置B中观察到的现象是___________;
②装置D中观察到酚酞溶液变红色,由此可知分解的产物中有_________(写化学式)。
(7)乙组同学认为硫酸铝铵晶体受热分解的产物中还有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和上图2所示装置连接进行实验。观察到装置E中_______,证明了有SO3生成;而F装置中__________、H最终没有胀大,表明没有SO2和N2生成。
(四)硫酸铝铵晶体成分的定量探究
(8)为确定硫酸铝铵晶体的组成,进行如下实验:
【实验1】称取45.3g样品与足量氯化钡溶液充分反应,生成白色沉淀46.6g。
【实验2】称取45.3g样品在空气中持续加热,测定剩余固体质量随温度变化的曲线如图所示。
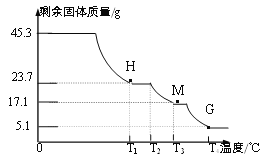
①固体H是T1℃刚好完全失去结晶水的产物,
则结晶水的个数x=________;
②T3℃时固体M的化学式______。
③请写出T2℃→T4℃段发生反应的总化学方程式:__________。
【答案】 表面形成致密而结实的氧化膜 B A 2Al +6HCl=2AlCl3 + 3H2↑ 增大反应物的接触面积,充分反应或加快反应 a 变蓝色 NH3 产生白色沉淀 不褪色或无现象 12 Al2(SO4)3 2 NH4Al(SO4)2 ![]() Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑
Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑
【解析】(一)铝的广泛应用(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是铝在常温下和空气中的氧气反应,表面形成致密而结实的氧化膜,阻止铝的进一步锈蚀;使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指铝元素; (2)金属和合金都属于金属材料。“铝镓合金”它属于金属材料;(3)铝片与稀盐酸反应生成氢气和氯化铝,该反应的化学方程式:2Al +6HCl=2AlCl3 + 3H2↑;(二)(4)铝土矿粉碎的目的是增大反应物的接触面积,使反应更充分、更迅速;(5)氧化铁和氧化铝都能与硫酸反应生成可溶性盐,二氧化硅与酸不反应, “有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2,正确;稀硫酸过量的目的是保证Al2O3和氧化铁都溶解完全,错误;(三) (6) ①实验中,装置B中观察到的现象是固体变成蓝色,因为硫酸铜和水反应生成硫酸铜晶体;②装置D中观察到酚酞溶液变红色,由此可知分解的产物中有氨气(NH3),因氨气溶于水生成氨水,是碱,溶液呈碱性;(7)观察到装置E中白色沉淀,证明了有SO3生成,因为三氧化硫和水生成硫酸,硫酸和氯化钡生成不溶于酸的硫酸钡白色沉淀;而F装置中溶液不变色,说明没有二氧化硫,因二氧化硫能使高锰酸钾溶液褪色,H最终没有胀大,表明没有N2生成;(四)①固体H是T1℃刚好完全失去结晶水的产物,故结晶水的质量为45.3g-23.7g=21.6g,则结晶水的个数x=216÷18=12;②T1℃~T3℃时,硫酸铝铵分解生成硫酸铝,固体M为硫酸铝,化学式:Al2(SO4)3;③T2℃→T4℃段发生反应的总化学方程式:2 NH4Al(SO4)2 ![]() Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑。
Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】水是人类宝贵的自然资源。
(1)天然水中含有许多杂质,实验室常用过滤方法除去水中不溶性杂质,过滤需要用到的仪器有带铁圈的铁架台、烧杯、漏斗和__________(填仪器名称)。
(2)在电解水的实验中,与电源正极相连的玻璃管上方产生的是____气。
(3)甲和乙两种固体物质的溶解度曲线如图所示。
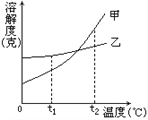
①将t1℃的甲和乙饱和溶液各100g升温至t2℃,此时两种溶液中溶剂的质量:甲____乙(填“>”、“=”或“<”)。
②乙物质中含有少量的甲,可采用__________________法将乙物质提纯。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据初中学习的化学知识回答下列问题:
① 霓虹灯中充入的气体是_____;
② 人工降雨常使用干冰,干冰的化学式是_____;
③ 能够还原氧化铜的非金属单质的化学式是_____;
④ 某物质焰色反应呈黄色,说明该物质中一定含有_____元素;
⑤ 引起酸雨的主要物质是_____,它是一种酸性氧化物,实验室可用_____吸收以减少污染;
⑥ 稀硫酸可用于除去铁锈,反应的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】今年1月我省持续多天降雪,南京禄口机场使用了环保型融雪剂醋酸钾(CH3COOK)除雪,避免因积雪导致大面积航班延误。

(1)采用撒固体盐融雪,其原因是形成溶液的凝固点_________(选填“升高”或“降低)。
(2)环保型融雪剂醋酸钾,属于_______(选填“氧化物”或“有机物”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】哈尔滨是一个因修建铁路而形成的近代城市。你知道吗?咱们道外区的“道”指的就是1901年建成的“滨洲铁路”。现如今,哈尔滨站的改造也在如火如荼的进行中。建成后,这座百年老站将焕发出新的光辉!请回答:

(1)最早的蒸汽机车运行时的能量来源是煤,在其运行过程中的能量转化是:①_______能→内能→② _________能;
(2)随着时代的发展,火车的能量来源换成了柴油和电力,柴油是①_______炼制的产品,相比于烧柴油的火车,电力机车不会向大气中排放②_____________(填两种)等气体,更为清洁环保。
(3)新哈站改造过程中会大量用到玻璃,玻璃中含有的一种化学式为Na2SiO3的成分,其中硅元素的化合价为①________。作为哈尔滨的小主人,请你结合所学的化学知识,从环境保护的角度为新哈站的建设提一条合理的建议②___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国是世界上已知矿物种类比较齐全的少数国家之一,矿物储量也很丰富。铝土矿就是一种常见的金属矿石,为测定一种铝土矿样品(主要成分是Al2O3,假设其余成分不参与反应,也不溶于水)的纯度,同学们做了如图所示的实验:
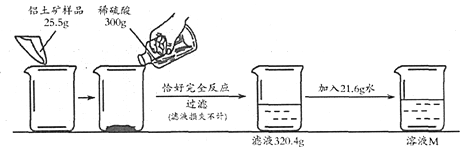
请回答:
(1)实验中发生反应的化学方程式为_____________________;
(2)根据己知条件,列出求解实验中参加反应的硫酸的质量(x)的比例式为_______;
(3)题中铝土矿样品的纯度(Al2O3的质量分数)为________;
(4)实验所用的稀硫酸的溶质的质量分数为________;
(5)实验最终所得到的溶液M中,溶质和溶剂质量的最简整数比为_______;
(6)若工业上需炼制135t含铝80%的铝合金,需要题中这种铝土矿的质量是_______。(假设除氧化铝外,其余成分均不含铝元素,炼制过程中没有铝元素损失)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】十九大报告提出:“打好污染防治攻坚战,建设美丽中国”。山西省围绕“控煤、治污、管车、降尘”等领域持续推进大气污染治理。
(1)控煤——煤改气、煤改电,用天然气代替燃煤。请写出天然气燃烧的化学方程式______。
(2)治污—— 禁止燃放烟花爆竹。下列图标中表示禁止燃放鞭炮的是_______。
a. b.
b. c.
c. d.
d.
(3)管车—— 淘汰老旧机动车,投入清洁能源汽车。下列属于清洁能源汽车的是_______。
a.氢能源汽车 b.太阳能汽车 c.燃油汽车
(4)降尘—— 扬尘污染是造成重污染天气的主要原因之一,请写出一种你知道的降尘方法__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组进行CO2气体的制取、并验证CO2能与NaOH发生化学反应的实验。
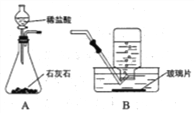
(1)用上图装置制取CO2气体。
①写出反应的化学方程式: ____________。
②A装置用分液漏斗加液,与用长颈漏斗加液比较,其优点是_______________。
③从B装置中取出收集满CO2气体集气瓶的操作是_____________。
(2)通过C装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量溶质质量分数为20%的NaOH溶液,振荡集气瓶后打开止水夹。
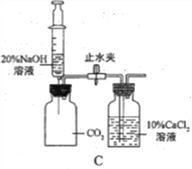
①打开止水夹后观察到的现象是______。
②反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com