【答案】
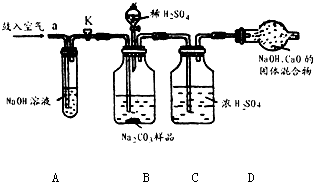
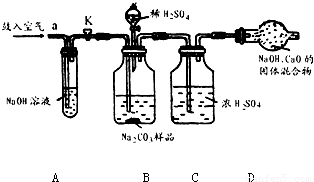
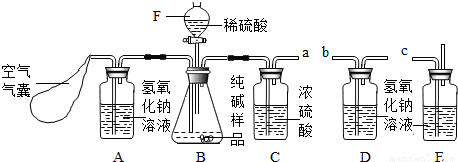
分析:(1)浓硫酸具有吸水性,常用作干燥剂以除去混合气体中的水分;氢氧化钠溶液能吸收二氧化碳气体,常用来除去混合气体中的二氧化碳;
实验过程中,为减小误差需要先把装置内的二氧化碳全部排出,还需要把装置内生成的二氧化碳气体全部被吸收;
(2)确保实验顺利完成,需要考虑把5.3g样品中的碳酸钠完全反应,因此,可通过假设样品为纯净碳酸钠完全反应需要消耗硫酸的量确定要在分液漏斗中加入稀硫酸的量;
装置D因吸收产生的二氧化碳而质量增加,根据装置D增加的二氧化碳质量,利用反应的化学方程式可计算参加反应碳酸钠的质量.
解答:解:(1)装置A中盛放氢氧化钠溶液可以吸收混合气体中的二氧化碳.挤压空气气囊压入空气时,空气中的二氧化碳被吸收;
故答案为:除去鼓入的空气中的二氧化碳;
装置C中盛放的浓硫酸可吸收混合气体中的水分.连接在装置B、D之间,起到除去由装置B排出气体中的水分,防止水分进入装置D而影响实验结果;
故答案为:防止B中的水蒸气进入D中;
装置E中盛放氢氧化钠溶液,并且连接在装置D之后,可吸收来自空气中二氧化碳对装置D的影响;
故答案为:防止空气中的二氧化碳和水进入D中影响实验结果;
步骤③挤压空气气囊,持续约1分钟.通过压入除出二氧化碳的空气把装置内残存含二氧化碳的空气排气,避免空气中二氧化碳对实验的影响;
故答案为:用除去二氧化碳的空气赶走体系中的二氧化碳;
步骤⑥是在实验中反应结束后,挤压空气气囊,持续约1分钟,可以把残留在装置内的二氧化碳全部排出,由装置D进行完全吸收,确保测定的准确度;
故答案为:用除去二氧化碳的空气将反应产生的二氧化碳全部赶入D中;
(2)若5.3g固体全部为碳酸,设完全反应消耗10%稀硫酸的质量为x,
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 98
5.3g x×10%
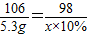
解之得 x=49g
10%的稀硫酸(密度为1.07g/mL)的体积=
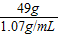
≈45.8mL
故答案为:45.8;
装置D实验前后质量m
1为51.20g,m
2为53.18g,则装置D吸收二氧化碳的质量=53.18g-51.20g=1.98g;
设参加反应碳酸钠的质量为y
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 44
y 1.98g
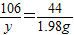
解之得 y=4.77g
样品中Na
2CO
3的质量分数=
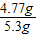
×100%=90%
故答案为:90%.
点评:在计算长颈漏斗内所加稀硫酸的量时要特别注意:确保实验顺利完成,必须保证稀硫酸的量足量,因此必须假设所取样品为纯净的碳酸钠来计算完全反应所需要稀硫酸的量.

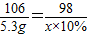 解之得 x=49g
解之得 x=49g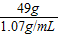 ≈45.8mL
≈45.8mL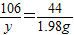 解之得 y=4.77g
解之得 y=4.77g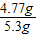 ×100%=90%
×100%=90%

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案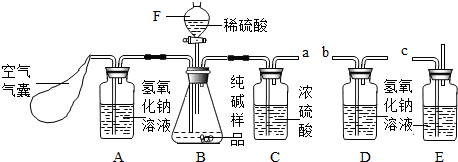
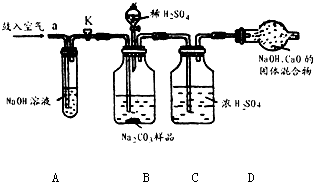 某Na2CO3样品中混有一些NaCl,用下列装置测定其纯度:
某Na2CO3样品中混有一些NaCl,用下列装置测定其纯度: 某Na2CO3样品中混有一些NaCl,用下列装置测定其纯度:
某Na2CO3样品中混有一些NaCl,用下列装置测定其纯度: