
| 实验中可能出现的现象 | 结论 |
| ①黑色粉末没有溶解 | 假设1成立 |
| ② | 假设2成立 |
| ③ | 假设3成立 |
分析 根据炭粉、氧化铜、硫酸铜的物理、化学性质作答.硫酸铜溶液显蓝色,炭粉、氧化铜均为黑色,木炭有还原性,可以还原氧化铜.
解答 解:(1)根据题意,可以做出三种假设,即第一种可能是只有炭粉,第二中可能是只有氧化铜,第三种可能是氧化铜与炭粉的混合物;所以假设2是:黑色粉末是氧化铜.
(2)炭粉不会与稀硫酸反应,氧化铜会与稀硫酸反应生成硫酸铜溶液,硫酸铜溶液显蓝色,所以设计实验方案的现象和结论如下:
| 实验中可能出现的现象 | 结论 |
| ①溶液为无色,有黑色不溶物 | 假设1成立 |
| ②溶液为蓝色,无黑色不溶物 | 假设2成立 |
| ③溶液为蓝色,有黑色不溶物 | 假设3成立 |
| 实验中可能出现的现象 | 结论 |
| ①黑色粉末没有溶解 | 假设1成立 |
| ②黑色粉末全部溶解,溶液变蓝 | 假设2成立 |
| ③黑色粉末只是部分溶解,溶液变蓝 | 假设3成立 |
点评 本题考查了混合物成分的推断,完成此题,可以依据物质的性质结合题干提供的信息进行.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
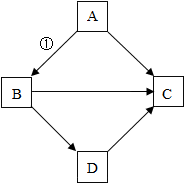 物质之间的相互转化是科学中的重要知识.某同学在复习物质性质时,绘制了如下框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.
物质之间的相互转化是科学中的重要知识.某同学在复习物质性质时,绘制了如下框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
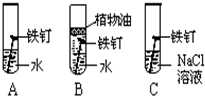

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实 验 操 作 | 实 验 现 象 | 结 论 |
| ①用试管取少量蒸馏水,滴入1-2滴无色酚酞试液,振荡 | 试管内溶液仍为无色 | 水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1-2滴无色酚酞试液,振荡 | 试管内溶液仍为无色 | Na+不能使无色酚酞试液变红色 |
| ③用试管取少量氢氧化钠溶液,滴入1-2滴无色酚酞试液,振荡 | 试管内溶液变为红色 | OH-能使无色酚酞试液变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com