
| A. |  | B. |  | ||
| C. | 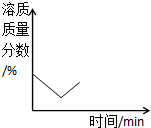 | D. |  |
分析 虽然生石灰遇水会放出大量热而使饱和溶液溶液升高;由于氧化钙能与水发生反应生成氢氧化钙,易被误解为增加了溶液中的溶质,其实是氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,溶液仍为饱和溶液.
解答 解:A、由于氧化钙与饱和溶液中的水发生反应而使溶液因此减少了水,溶质相应析出,溶液质量减小,故A错误;
B、生石灰遇水会放出大量热而使饱和溶液溶液升高,氢氧化钙的溶解度减小,恢复到原来的温度,此,溶质的溶解度也不变,故B正确;
C、饱和溶液随溶剂水的减少,溶质相应析出,变化后的溶液仍为饱和溶液,且溶液温度没有改变,根据相同温度下的同种溶质的饱和溶液的溶质质量分数相同,饱和溶液的溶质质量分数不变,故C错误;
D、由于氧化钙与饱和溶液中的水发生反应而使溶液因此减少了水,溶剂质量减小,故D错误.
故选B.
点评 全面分析影响饱和溶液的各种因素,是正确处理有关饱和溶液发生改变类问题的关键,可以体现思维的严密性.


科目:初中化学 来源: 题型:选择题
| A. | Al(OH)3是一种盐 | B. | AlCl3是一种碱 | ||
| C. | 上述反应是中和反应 | D. | 上述反应是置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 学习酸碱中和反应时,很多同学对其产生探究兴趣.
学习酸碱中和反应时,很多同学对其产生探究兴趣.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水是生命活动不可缺少的物质 | |
| B. | 水通电分解和水的蒸发都是化学变化 | |
| C. | 地球上有丰富的水资源,但淡水资源不足 | |
| D. | 净化水的方法有吸附、沉淀、过滤和蒸馏等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 我们的生活离不开水 | B. | 用肥皂水可区分硬水和软水 | ||
| C. | 水结冰后分子停止运动 | D. | 长期饮用硬水对人体的健康不利 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com