
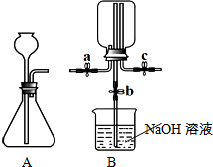
 甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验
甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验分析 (1)甲组实验:大理石的主要成分碳酸钙与盐酸反应时放出气体二氧化碳,二氧化碳气体密度大于空气,收集时从集气瓶底部开始慢慢充满集气瓶,当有二氧化碳从上方导管排出时,集气瓶内二氧化碳已收集满;若向集气瓶内加入少量氢氧化钠溶液,瓶内二氧化碳被吸收而使压强减小,会使氢氧化钠溶液不断进入;
(2)乙组实验:把浓硫酸加入浓盐酸中,浓硫酸遇水放出的热会加快浓盐酸的挥发,而产生大量HCl气体;HCl气体的进入使瓶内压强增大,观察到气球膨胀;当把氢氧化钠与浓氨水混合产生的氨气也通入集气瓶时,氨气与瓶内HCl气体反应形成固体氯化铵,观察到出现白烟,由于两气体的不断反应而会使瓶内气体又减少,压强渐渐接近外界大气压,观察到气球恢复原状.
解答 解:(1)①大理石中的碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
②二氧化碳从a管进入,瓶内空气从位于上部的导管c排出,二氧化碳密度大于空气会从底部逐渐充满瓶子,因此,当有二氧化碳气体从c管排出时说明瓶内已收集满二氧化碳,因此可用燃烧的木条放在c导管口,木条熄灭则可证明二氧化碳已收集满;
③用冷毛巾捂住B中集气瓶,瓶内二氧化碳气体遇冷收缩引起烧杯内的氢氧化钠溶液进入集气瓶,进入瓶内的氢氧化钠溶液吸收二氧化碳而使瓶内气体减少,烧杯内氢氧化钠溶液则会更多地流入集气瓶,反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;
(2)①浓盐酸具有挥发性,当向浓盐酸中加入浓硫酸时,浓硫酸遇到溶液中的水而放出大量的热,使气体HCl的溶解度减小,加剧浓盐酸的挥发,而产生大量HCl气体;
②NaOH固体和浓氨水混合后,产生大量的氨气,氨气与集气瓶内的HCl气体发生反应生成固体氯化铵,当通入的氨气恰好与瓶内HCl气体完全反应时,瓶内压强恢复至原来的压强而与外界大气压强相等,因此气球恢复至原状,烧杯内氢氧化钠溶液不能流入集气瓶中;
故答案为:
(1)①CaCO3+2HCl=CaCl2+H2O+CO2↑
②将燃着的木条放在c右端的导管口处,若熄灭则气体已集满.
③烧杯中的无色液体沿导管进入到集气瓶中(或形成喷泉);2NaOH+CO2=Na2CO3+H2O
(2)①浓硫酸溶于水会放出大量热,使浓盐酸中的HCl气体溶解度减小,导致HCl气体逸出.
②NH3和HCl反应生成固体NH4Cl,且两者恰好完全反应,集气瓶内的气压与外界大气压相等.
点评 准确理解改进的收集装置的作用,进而掌握该改进装置的使用,这是解答本实验题所需要具有的实验能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
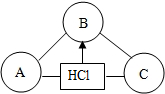 构建知识网络是一种重要的学习方法.右图是关于盐酸化学性质的知识网络,“-”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质.
构建知识网络是一种重要的学习方法.右图是关于盐酸化学性质的知识网络,“-”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应为置换反应 | B. | 该反应会放出大量热 | ||
| C. | Fe2O3为氧化物 | D. | 该反应方程式中的x为3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸有吸水性--用作干燥剂 | |
| B. | 稀有气体化学性质稳定--用作保护气 | |
| C. | 氧气密度比空气略大--用于急救病人 | |
| D. | 干冰升华吸热--用于人工降雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
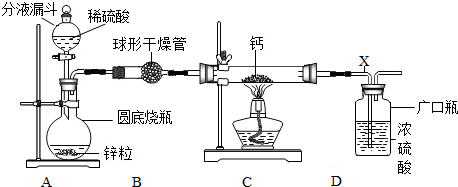
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com