
分析 根据反应物、生成物及其质量守恒定律可以书写化学方程式;
①硫酸与氢氧化钙反应生成硫酸钙和水,②酸雨能够腐蚀建筑物、破坏植被等,可以据此解答该题;③根据使用脱硫煤、开发使用新能源等可以减少二氧化硫的排放进行解答.
解答 解:硫燃烧生成二氧化硫;二氧化硫和水反应生成亚硫酸,亚硫酸能和氧气反应生成硫酸,反应的化学方程式分别为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2、SO2+H2O═H2SO3、2H2SO3+O2═2H2SO4.
①硫酸与氢氧化钙反应生成硫酸钙和水,化学方程式:H2SO4+Ca(OH)2=CaSO4+2H2O.
②酸雨能够腐蚀建筑物、破坏植被等.
③使用脱硫煤、开发使用新能源等可以减少二氧化硫的排放.故填:使用脱硫煤、开发使用新能源等
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2、SO2+H2O═H2SO3;2H2SO3+O2═2H2SO4.
①H2SO4+Ca(OH)2=CaSO4+2H2O.
②腐蚀雕像(腐蚀建筑物,破坏森林植被等)③使用脱硫煤、开发使用新能源等.
点评 正确认识造成空气污染的主要原因--粉尘和有害气体,对于判断有关空气污染类问题来说是根本.


科目:初中化学 来源: 题型:选择题
| A. | 氧气约占空气体积的21% | |
| B. | 饼干在空气中变软是因为空气中含有氧气 | |
| C. | 稀有气体通电后会发出不同的光 | |
| D. | 空气中的氧气主要来自植物的光合作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | M的金属活动性比Cu强 | B. | 该反应属于置换反应 | ||
| C. | 金属M可能是铝 | D. | 该反应前后M的化合价发生了改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碱式碳酸铜加热得到氧化铜、水和二氧化碳 | |
| B. | 液化石油气燃烧 | |
| C. | 石油分馏制得汽油、柴油等物质 | |
| D. | 秸秆、杂草发酵产生甲烷 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
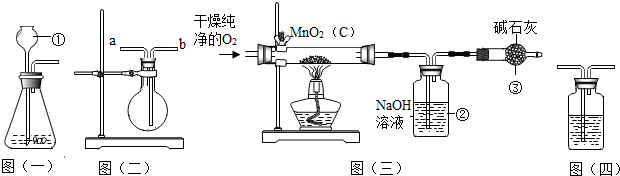
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com