


分析 根据原子的知识、溶质质量分数的计算、变质氢氧化钠的成分的实验探究以及根据化学方程式的计算的知识进行分析解答即可.
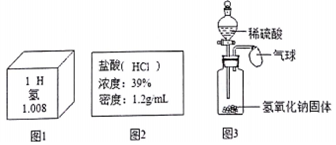
解答 解:(1)A.氢元素属于非金属元素,正确;
B.氢原子核内质子数为1,正确;
C.氢原子的相对原子质量为1.008,错误
D.氢原子的结构示意图为 ,正确;
,正确;
故填:C;
(2)要配制500g溶质质量分数为7.8%的稀盐酸溶液,需要量取该盐酸的体积为x,则有:500g×7.8%=1.2g/mL×x×39%,x=83.3mL,故填:83.3;
(3)要证明烧碱溶液变质,又能除去产生的杂质,根据已有的知识,氢氧化钠变质就是和空气中的二氧化碳反应生成碳酸钠和水,要检验碳酸钠,可以利用产生沉淀的方法,要除去碳酸钠,不能引入新的杂质,故可以选用氢氧化钙溶液,如果产生白色沉淀,则氢氧化钠已经变质,且氢氧化钙与碳酸钠反应生成的是碳酸钙沉淀和氢氧化钠,故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(4)①溶液变成红色,故甲同学先向氢氧化钠溶液中加入的是几滴酚酞试液;然后向变红的氢氧化钠溶液中滴加稀硫酸并不断减搅拌,最终发现红色消失,证明两种物质发生了化学反应.故填:酚酞;
②酸与碱发生中和反应会放出热量,则瓶内的压强增大,大于大气压,故会观察到气球变大,但是由于使用的是氢氧化钠固体,氢氧化钠固体溶于水也会放出热,故该实验不能证明两种物质发生化学反应,故填:变大;氢氧化钠固体溶于水会放出热量使瓶内的压强增大;
(5)向含有稀盐酸和氯化铜的混合溶液中滴加NaOH溶液,则氢氧化钠先与盐酸反应,沉淀的质量横坐标不会从0开始,当盐酸反应完,氢氧化钠与氯化铜反应产生沉淀,故填:D.
(6)完全中和100g溶质质量分数为16%的氢氧化钠溶液,至少需要溶质质量分数为9.8%的稀硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98 80
9.8%x 100g×16%
$\frac{98}{80}=\frac{9.8%x}{100g×16%}$
x=200g
答:需要溶质质量分数为9.8%的稀硫酸200g.
点评 本题考查的是常见的酸碱中和以及根据化学方程式的计算的知识,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气可用于生物呼吸 | B. | 活性炭可用于除去冰箱中的异味 | ||
| C. | 铜丝可用作导线 | D. | 干冰可用于人工降雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 | |
| 开始反应 | 420 | 515 | 305 | 490 |
| 剧烈反应 | 490 | 540 | 350 | 545 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 催化剂是催化反应的核心 | |
| B. | 金属硅化物属于化合物 | |
| C. | 在化学反应中能加快其他物质的反应速率,而本身的质量和性质在化学反应前后都没有改变的物质称为催化剂 | |
| D. | 催化剂只能改变化学反应速率,不能增加或减少生成物的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是( )
用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是( )| A. | 纯净的锌 | B. | 含铜的锌 | ||
| C. | 含有不与酸反应的杂质的锌 | D. | 含有不与酸反应的杂质的铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com