
 向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应.
向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应. K+
K+ CO32-
CO32- OH-
OH-分析 (1)碳酸钾和氢氧化钡反应生成白色沉淀碳酸钡和氢氧化钾;
(2)根据图中提供的信息可以判断每种符号代表的离子符号;
(3)碳酸钾能和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钾,和氯化钡反应生成白色沉淀碳酸钡和氯化钾.
解答 解:(1)碳酸钾和氢氧化钡反应生成白色沉淀碳酸钡和氢氧化钾,因此可以观察到的实验现象是产生白色沉淀.
故填:产生白色沉淀.
(2)由图中信息可知, 表示 K+,
表示 K+, 表示CO32-,
表示CO32-, 表示 OH-.
表示 OH-.
故填:K+;CO32-;OH-.
(3)碳酸钾能和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钾,和氯化钡反应生成白色沉淀碳酸钡和氯化钾,因此下列物质能与K2CO3溶液反应产生类似上述实验现象的是Ca(OH)2和BaCl2.
故选:AC.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 长期放置后不会分层的液体一定是溶液 | |
| B. | 配制好6%的NaCl溶液,装瓶时不小心撒漏一部分,瓶中NaCl溶液浓度仍为6% | |
| C. | KNO3饱和溶液一定比KNO3不饱和溶液溶质质量分数大 | |
| D. | 降低饱和溶液的温度,一定有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 10 | 30 | 50 | 70 | 90 |
| 溶解度/g | 27.7 | 39.3 | 49.0 | 54.1 | 51.1 |
| A. | 硫酸镁的溶解度随温度升高而增大 | |
| B. | 10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液 | |
| C. | 50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100 | |
| D. | 70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂(足量) | 操作方法 |
| A | CO(CO2) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| B | K2CO3(KCl) | 稀盐酸 | 加入稀盐酸、蒸发、结晶 |
| C | FeSO4(CuSO4) | 锌粉 | 加入锌粉并过滤 |
| D | Zn(Fe) | 稀硫酸 | 加入稀硫酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
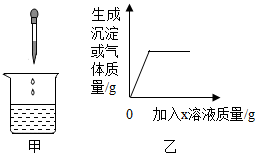 向烧杯中逐渐加入X溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是( )
向烧杯中逐渐加入X溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是( )| 烧杯中的物质 | X溶液 | |
| A | 稀硫酸 | 氯化钡溶液 |
| B | 氯化钠溶液 | 硝酸银溶液 |
| C | 硫酸和硫酸铜混合溶液 | 氢氧化钠溶液 |
| D | 碳酸氢钠溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com