
【题目】兴趣小组某同学在做铜与硝酸银溶液反应的实验,当观察到铜丝表面有银白色固体出现时,发现试管内溶液未显蓝色,与所学知识不符。组内同学即展开讨论,认为溶液未显蓝色是因为铜离子的浓度太小,于是对铜离子浓度太小的原因进行了如下猜想:
猜想一:硝酸银溶液浓度不够大。
猜想二:铜丝中含有比铜活泼的金属
猜想三:_____________________
(实验验证)
(1)验证猜想一:你的方案是____________________。
(2)验证猜想二:取上述相同的铜丝,选择一种酸或盐溶液在相同条件下进行实验,观察实验现象,得出结论。
请你在矩形内画出实验装置图,并标出所选物质。
 _____________
_____________
(3)验证猜想三:进一步实验______________
【答案】 略 略 略 略
【解析】铜与硝酸银溶液反应的时间太短,或反应速率太慢,都可能导致反应一定时间后,溶液中的铜离子浓度太低;【实验验证】(1)根据控制变量的原则,验证猜想一:方案是其它条件不变,用浓度更大的AgNO3溶液,重复实验,观察实验现象,得出结论;(2) 金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。验证猜想二:取上述相同的铜丝,分别和硫酸或硫酸铜溶液在相同条件下进行实验,观察实验现象,如果有气泡产生或硫酸铜的溶液颜色变浅或变色,可证明铜丝中有比铜活泼的金属,反之,没有; 实验装置如图: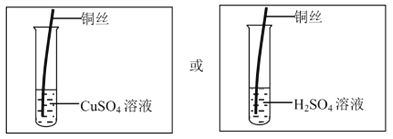


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:初中化学 来源: 题型:
【题目】某兴趣小组同学去盐场观,带回了部分粗盐样品,并对其进行了如下探究:
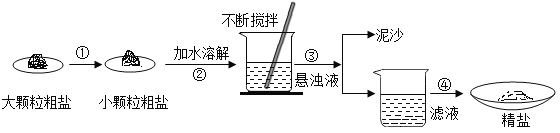
(1)操作①中必须用到的一种仪器名称是__________________;
(2)操作②中玻璃棒的作用为_______________________________;操作③的名称是__________;
(3)用提纯得到的“精盐”配制100g7.5%的氯化钠溶液经检测,溶质质量分数偏小,原因可能有_____________(填序号)
A.称量使用的砝码有缺损 B.精量时特盐与砝码放反了
C.量取水时仰视读数 D.装瓶时,有少量溶液酒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的一精盐”又作了如下处理:
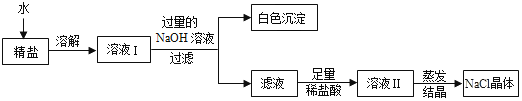
①生成白色沉淀的化学方程式________________________________________________;
②在得到的滤液中加入足量稀盐酸的目的是___________________________________________;
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将______________(填大于”、“小于”或“等于”)原精盐中NaCl的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法正确的是
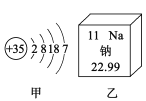
A. 甲元素属于金属元素
B. 甲、乙两种元素形成化合物的化学式是NaBr
C. 乙原子的核内中子数为11
D. 甲原子核外共有5个电子层
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属——工业的脊梁
金属及合金广泛应用于生活、生产和航天军工。
资料:水圈和岩石圈中含有丰富的镁元素。工业生产中,可用菱镁矿做原科制'备金属镁,流程如图所示:
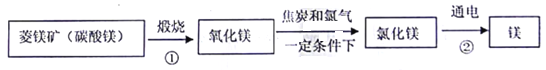
请回答下列问题:
(l)已知①和②属于分解反应,化学方程式分别为_________和___________。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备很多其他金属,请举一例说明(用化学方程式表示其制备原理)______________。
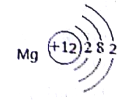
(3)下图是镁原子结构示意图,镁化学性质活泼,原因是________。四大圈层中含有下列物质:①硫酸铜;②氯化钠;③硫酸;④氢氧化钙;⑤氧气。其中能和铁反应的物质有(填序号)________。
(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,瓶壁上有黑色物质生成,她认为这种黑色物质是碳单质。在上述过程中,小梅运用的科学方法有______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜元素有多种氧化物,如CuO、Cu2O.称取14.4g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
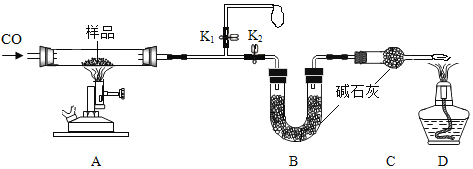
A. 装置B的作用是吸收反应生成的H2O和CO2
B. 实验开始前应先关闭K2,打开K1,让CO通一段时间
C. 根据实验数据进行计算,可以确定该固体为Cu2O
D. 若缺少装置C,则实验所得Cu、O个数比偏高
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镓是一种奇妙的金属,放在手心马上熔化,犹如荷时上的水珠流来流去。
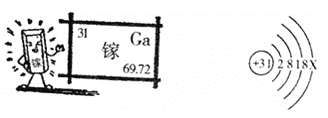
请阅读信息后回答:
(1)金属镓_____(填物理性质);
(2)镓原子结构示意图中X的数值______________;
(3)镓的氧化物的化学式______________;
(4)氮化镓(GaN)是第三代半导体材料,般采用GaCl3与NH3在一定条件下反应制得,同时得到另一种化合物。该反应的化学方程式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全球最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想] 甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
[讨论交流]其他同学认为小晴的实验设计不严谨,原因是____________________________。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用下图进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)
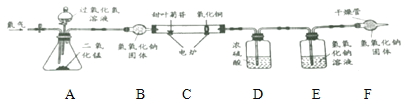
(1)实验前要通一会儿氮气,目的是_________________。
(2)A装置中发生反应的化学方程式为__________________________。
[数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g, E装置增重8.36g。(产物被完全吸收)
[分析与结论]数据分析: 4.02g 甜叶菊苷中氧元素的质量为___g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是_____________。 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化锰和过氧化氢酶均能催化过氧化氢分解制取氧气。为比较两者的催化能力,小明按图甲所示装置进行了如下实验。
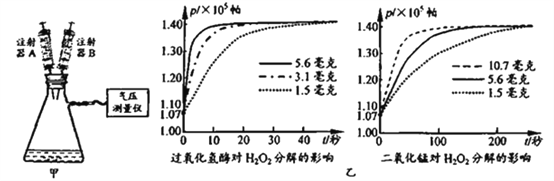
①取1.5毫克过氧化氢酶和8毫升蒸馏水加入容器中,搅拌后塞紧橡皮塞。
②用注射器A从容器中抽出2毫升气体,用注射器B将2毫升H2O2溶液注入容器中,采集数据.直至反应结束。
③用3.1毫克、3.6毫克过氧化氢酶及1.5毫克、5.6毫克、10.7毫克二氧化锰重复上述实验,获取数据如图乙。
(1)步骤②将注射器B中的2mL H2O2溶液全部注入容器前,用注射器A先从容器中抽出2毫升气体,其目的是__________。
(2)小明分析相关数据,得出“过氧化氢酶对过氧化氢的催化能力比二氧化锰强”这一结论,其依据是_____________。
(3)查阅资料得知:过氧化氢分解为放热反应。小明推测:过氧化氢酶质量过大,可能导致实验过程中过氧化氢分解突然变慢。请说明其理由:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com