
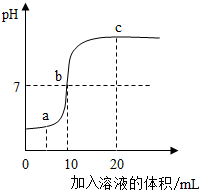
 在盐酸和氢氧化钠溶液反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象.据图分析能得出的结论正确的是( )
在盐酸和氢氧化钠溶液反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象.据图分析能得出的结论正确的是( )| A. | a点对应的溶液的溶质只有NaCl,加入石蕊或酚酞都不变色 | |
| B. | b点表示稀盐酸和加入的NaOH溶液质量一定相同 | |
| C. | a到c的过程中,NaCl逐渐增加 | |
| D. | 反应进行到b点时放出的热量达到最大值 |
分析 A、根据A点pH<7,硫酸过量解答;
根据当溶液的pH<7时,溶液显酸性,当溶液的pH>7时,溶液显碱性,当溶液的pH=7时,溶液显中性解答;
B、根据M点溶液的pH=7,溶液为中性解答;
C、根据随着反应进行氯化钠质量不断增加分析;
D、根据中和反应放热回答.
解答 解:A、盐酸能与氢氧化钠反应生成氯化钠和水,当加入的溶液质量为ag时,溶液的pH小于7,显酸性,故溶液中除了氯化钠还有没参加反应的盐酸,故错;
B、b点溶液的pH=7,溶液为中性,表示酸碱恰好反应,稀盐酸和加入的NaOH溶液质量不一定相同,故错;
C、a到b的过程中,盐酸与氢氧化钠反应,NaCl逐渐增加,b到c的过程中,反应停止,NaCl不再增加,故错;
D、中和反应放热的,当B时,a到b的过程中,盐酸与氢氧化钠反应,不停放热,当b点时反应停止,不再放热,放出的热量达到最大值.故对;
故选:D.
点评 酸碱中和反应结合图象知识来考查,难度适中,考查的知识面较广.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 主食 | 米饭 |
| 副食 | 红烧肉 清蒸鱼 炒蛋 |
| 饮料 | 牛奶 |
| A. | 鸡块 | B. | 大白菜 | C. | 糖醋排骨 | D. | 豆腐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A | B | C | D | |
| 体液 | 血浆 | 唾液 | 胃液 | 尿液 |
| pH | 7.35~7.45 | 6.6~7.1 | 0.9~1.5 | 4.7~8.4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 时间(min) 浓度 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入WgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入WgFe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com