
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2012年江苏省连云港市中考模拟考试化学试卷(解析版) 题型:填空题
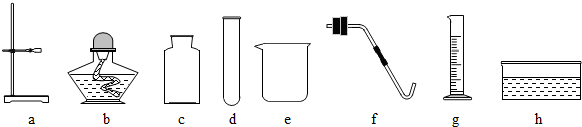
(13分)下图是实验室常用的装置,请回答下列问题: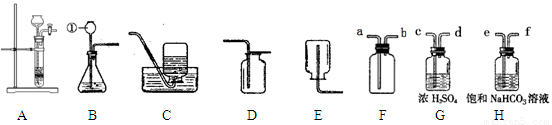
⑴写出仪器①的名称 。收集某气体能采用E装置,由此推测该气体具有的
性质是 。
⑵实验室制备并收集氧气的装置组合是 (填装置序号),反应的化学方程式为 ;若用F装置收集该气体,则气体应从 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是 。
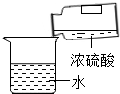
⑶实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项字母编号)。
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
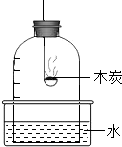
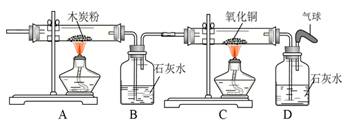
(4)将氧气通入如下图所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固
体变为红色,则进入装置B的气体一定含有 ,B处发生反应的化学方程式是 。
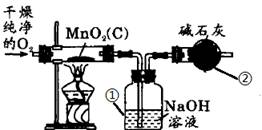
⑸实验室制取氧气时常用二氧化锰作催化剂。某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
①如下图所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是 。
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入
装置进行证明。
③现称取5.0 g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 B.空气中氧气含量的测定
B.空气中氧气含量的测定
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
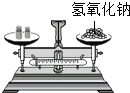
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
查看答案和解析>>
科目:初中化学 来源:2011-2012学年度江苏省南京市溧水县第二学期第二次调研测试化学试卷(解析版) 题型:计算题
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com