
 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.如图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.如图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.分析 (1)根据铁和稀硫酸反应能生成硫酸亚铁和氢气进行分析;
(2)根据氢气不溶于水,不能和氢氧化钠反应进行分析;
(3)根据关闭止水夹时,反应生成的硫酸亚铁能够进入氢氧化钠溶液中,并且能够发生化学反应进行分析;
(4)根据氢氧化钠和硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠进行分析;
(5)根据实验结束,B溶液中的主要成分是硫酸钠,硫酸钠显中性进行分析.
解答 解:(1)铁和稀硫酸反应能生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(2)A试管中反应开始时,打开止水夹,生成的氢气进入氢氧化钠溶液中,产生大量的气泡,B试管中看到的现象是导管口有气泡产生;
(3)若要在该装置中得到Fe(OH)2白色絮状沉淀,应该关闭止水夹,反应生成的硫酸亚铁能够进入氢氧化钠溶液中,并且能够发生化学反应生成硫酸钠和氢氧化亚铁,同时把导管中的空气排入B中,并且通过出气口排出,使氢氧化亚铁不能与氧气充分接触,从而达到防止被氧化的目的;
(4)氢氧化钠和硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠,化学方程式为:2NaOH+FeSO4=Na2SO4+Fe(OH)2↓;
(5)实验结束,B溶液中的主要成分是硫酸钠,硫酸钠显中性,所以先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测试液于pH试纸上进行测定,测得的结果与该溶液的实际pH相比结果将不变.
故答案为:(1)Fe+H2SO4=FeSO4+H2↑;
(2)导管口有气泡产生;
(3)关闭止水夹;
(4)2NaOH+FeSO4=Na2SO4+Fe(OH)2↓;
(5)不变.
点评 本题考查了氢氧化亚铁的制备方法,题目难度中等,明确制备原理为解答关键,注意掌握氢氧化亚铁的性质及制备方法,试题培养了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
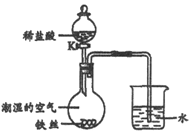 水在化学实验中具有重要作用.将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面上升;打开K,滴加稀盐酸,观察到导管内液面下降,导管口有气泡冒出,关闭K.请解释导管内液面上升和下降的原因:铁在潮湿的空气易生锈,消耗空气中的氧气,使瓶内压强减小,所以观察到导管内液面上升;盐酸和铁反应生成氢气,所以使瓶内压强变大,观察到导管内液面下降,导管口有气泡冒出.
水在化学实验中具有重要作用.将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面上升;打开K,滴加稀盐酸,观察到导管内液面下降,导管口有气泡冒出,关闭K.请解释导管内液面上升和下降的原因:铁在潮湿的空气易生锈,消耗空气中的氧气,使瓶内压强减小,所以观察到导管内液面上升;盐酸和铁反应生成氢气,所以使瓶内压强变大,观察到导管内液面下降,导管口有气泡冒出.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铝窗变旧变暗用砂纸或钢丝球打磨 | |
| B. | 用软水洗衣服比用硬水洗衣服效果好 | |
| C. | 煤炉上放一盆水以防煤气中毒 | |
| D. | 不锈钢壶里的水垢用大量稀盐酸长时间浸泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 图1中甲、乙溶液均为25℃时的饱和溶液 | |
| B. | 图2中甲、乙溶液的质量相等 | |
| C. | 乙的溶解度比甲的溶解度大 | |
| D. | 图3中固体甲对应的溶解度曲线是B |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
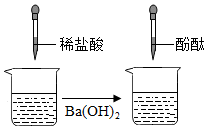 某实验小组同学用氢氧化钡溶液与稀盐酸进行酸碱中和反应实验.如图,反应一段时间发现未滴加酸碱指示剂,此时停止加入稀盐酸,立即向烧杯内滴加酚酞试液,振荡后溶液呈无色.实验结束后,他们对烧杯内的溶液的成分进行探究.(提示:BaCl2溶液呈中性)
某实验小组同学用氢氧化钡溶液与稀盐酸进行酸碱中和反应实验.如图,反应一段时间发现未滴加酸碱指示剂,此时停止加入稀盐酸,立即向烧杯内滴加酚酞试液,振荡后溶液呈无色.实验结束后,他们对烧杯内的溶液的成分进行探究.(提示:BaCl2溶液呈中性)| 实验步骤 | 实验现象 | 实验结论 |
| 取该溶液少量于试管中,加入Na2SO4溶液 | 产生白色沉淀 | 猜想三成立 |
| 另取该溶液少量于试管中,滴加紫色的石蕊试液(或加入锌粒) | 溶液由紫色变成红色(或有气泡冒出) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com