
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 各步骤结论 | 总结 | |||
| 实验一 | 将氯酸钾加热至融化,伸入带火星的木条, | 木条复燃 | 氯酸钾受热会分解产生氧气,但是速度很慢,且需要很高温度. | 二氧化锰是氯酸钾受热分解的催化剂 |
| 实验二 | 加热二氧化锰,伸入带火星的木条, | 木条不复燃 | 二氧化锰受热不产生氧气. | |
| 实验三 | (1)将氯酸钾和二氧化锰的混合物,伸入带火星的木条, | 木条迅速复 燃 | 二氧化锰能加快氯酸钾的分解 | |
分析 (1)根据实验现象和结论来反推实验操作;(2)根据实验的差别考虑;(3)根据催化剂的特点考虑.
解答 解:(1)将氯酸钾和二氧化锰一起加热伸入带火星的木条,木条迅速复燃,说明二氧化锰可以加速氯酸钾的分解;
(2)实验一和实验二是对比实验,通过对比得出二氧化锰的作用.
(3)催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变,要证明物质是催化剂,必须同时验证这三点,所以第一方面:比较MnO2在KClO3分解前后的质量;第二方面:验证从反应后的剩余物中分离出的物质是否能加快KClO3的分解.
故答案为:(1)将氯酸钾和二氧化锰的混合物,伸入带火星的木条,
(2)对比(或比照等);
(3)验证从反应后的剩余物中分离出的物质是否能加快KClO3的分解.
点评 解答该题关键要理解催化剂概念中的“一变、二不变”的涵义.一变是反应速度变,二不变是本身质量和化学性质.


 学习实践园地系列答案
学习实践园地系列答案科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧,产生浓厚的烟雾,生成有刺激性气味的气体 | |
| B. | 加热高锰酸钾制取氧气,要在试管口放一团蓬松的棉花 | |
| C. | 一氧化碳与氧化铁的反应,需要处理尾气 | |
| D. | 向氢氧化钠溶液中滴加无色酚酞试液,溶液变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| A | B | C | / | |
| 物质类别 | 酸 | 氧化物 | ||
| 化学式 | NaOH | SO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 90 mL | B. | 大于90 mL | C. | 小于90 mL | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
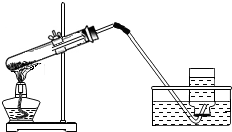 如图是实验室用高锰酸钾制取氧气的装置图.
如图是实验室用高锰酸钾制取氧气的装置图.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 某学校兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某学校兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com