
| A. | 这项措施的实行有助于节能减排 | |
| B. | 塑料购物袋是由合成材料制成的 | |
| C. | 塑料购物袋是造成“白色污染”的来源之一 | |
| D. | 为了防止“白色污染”,将塑料购物袋回收集中烧掉 |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
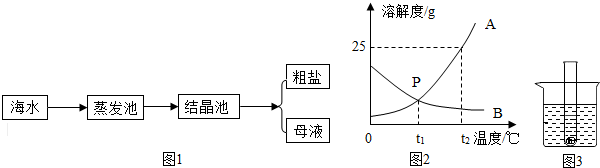
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
| ①干燥剂是否失效 | 取样品放入试管中,加入适量的水,触摸试管壁 | 用手摸没有 热感 | 没有氧化钙 |
| ②失效的干燥剂中是否含有氢氧化钙 | 加水充分搅拌过滤后,用pH试纸测其溶液的pH值 | pH>7 | 有氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 测定溶液的PH时,将试纸直接放入待测液中 | |
| B. | 将固体药品直接放在天平的托盘上称量 | |
| C. | 不慎将浓碱溶液沾到皮肤上,立即用大量水冲洗,再涂上硫酸 | |
| D. | 实验室用CO还原氧化铁时,先通CO,再点燃加热氧化铁的酒精喷灯 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
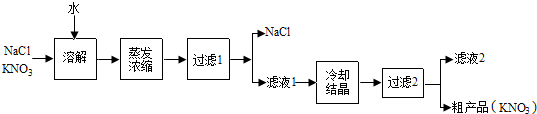
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com