
| 温度(℃) | 0 | 20 | 60 |
| 溶解度(g) | 7.4 | 11.1 | 18.2 |
 解得X=91g,含有水:591g-91g=500g,设0℃500g水中最多溶解溶质质量为Y则:
解得X=91g,含有水:591g-91g=500g,设0℃500g水中最多溶解溶质质量为Y则: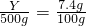 解得Y=37g,所以60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体质量为:91g-37g=54g.
解得Y=37g,所以60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体质量为:91g-37g=54g.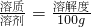 、
、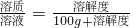 .
. 

科目:初中化学 来源: 题型:
| 温度(℃) | 0 | 20 | 60 |
| 溶解度(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省溧阳市中考模拟化学试卷(解析版) 题型:推断题
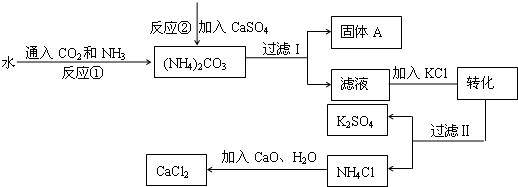
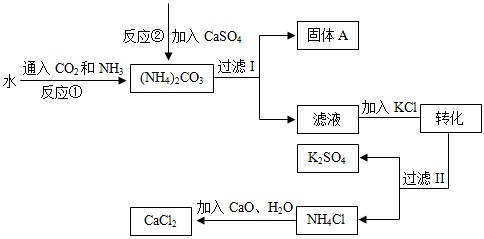
化工生产上通常将石膏(CaSO4)转化为硫酸钾肥料和氯化钙,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是该转化的流程图。

回答下列问题:
(1)写出反应①的化学方程式 。
(2)过滤I操作所得固体中,出CaSO4外还含有 (填化学式)等物质。
(3)过滤I操作所得滤液是溶液(NH4)2SO4。检验滤液中是否还含有CO32—的方法是 。
(4)已知不同温度下K2SO4的溶解度如下表:
|
温度(℃) |
0 |
20 |
60 |
|
溶解度(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4固体 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com