
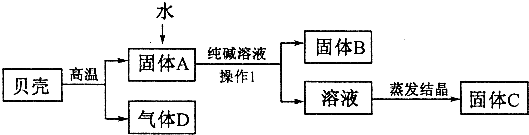
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量______ | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | ______ | 猜想成立 |
 CaO+CO2↑.
CaO+CO2↑. CaO+CO2↑.
CaO+CO2↑.

科目:初中化学 来源: 题型:

| A | B | C | D | |
| 盐酸加入Na2CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
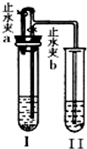 某化学小组同学按如图所示装置和表中所给试剂进行实验(图中铁架台等夹持仪器均已略去):
某化学小组同学按如图所示装置和表中所给试剂进行实验(图中铁架台等夹持仪器均已略去):| 组别 | A组 | B组 | C组 | D组 |
| 试管I | Ca(OH)2 稀HCl |
CaCO3 稀HCl |
Zn 稀H2SO4 |
Cu 稀H2SO4 |
| 试管Ⅱ | KNO3溶液 | Ca(OH)2溶液 | Ba(OH)2溶液 | Ba(OH)2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
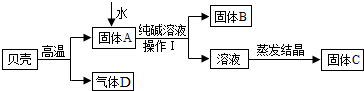
| ||
| ||
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 稀盐酸 稀盐酸 |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 出现白色沉淀 |
猜想成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com