
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 稀盐酸的质量 | 40g | 40g | 40g | 40g | 40g |
| 剩余固体质量 | 40.0g | X | 20.0g | 10.0g | 5.0g |
 =
= 解得x=7.3g
解得x=7.3g =100g;
=100g; =
= ,或
,或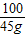 =
=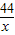
 =
=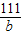 b=22.2g
b=22.2g =
=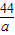 a=8.8g
a=8.8g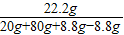 ×100%=22.2%;
×100%=22.2%;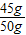 ×100%=90%
×100%=90%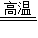 CaO+CO2↑
CaO+CO2↑ =
=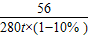
 =
=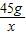 ,或
,或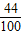 =
= ;
;

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实 验 | 1 | 2 | 3 | 4 |
| 石灰石样品的质量/g | 2.5 | 5 | 7.5 | 10 |
| 生成CO2的质量/g | 0.88 | 1.66 | 2.64 | 3.52 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
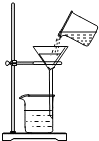 某学校化学兴趣小组的同学用洁净的塑料瓶从运河中取回一定量的水样,然后进行如下实验探究:
某学校化学兴趣小组的同学用洁净的塑料瓶从运河中取回一定量的水样,然后进行如下实验探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com