

分析 (2)②氯离子与银离子结合生成白色沉淀氯化银;
(3)根据反应原理和化学方程式进行分析.
解答 解:(2)②检验氯离子所用的试剂是硝酸银,氯离子与银离子形成难溶性沉淀氯化银,所以向清洗液中滴加硝酸银溶液,有白色沉淀生成,证明含有氯离子(Cl-),化学方程式为:AgNO3+NaCl═AgCl↓+NaNO3;
故填:向清洗液中滴加硝酸银溶液;有白色沉淀生成;AgNO3+NaCl═AgCl↓+NaNO3;
(3)利用化学方程式,可以看出只要测出所取海砂的质量和氯化银的质量,就能计算出海砂中氯离子的质量分数,所以需要直接测量的量是所取海砂的质量和氯化银的质量;
故填:所取海砂的质量和氯化银的质量.
答案:
(2)向清洗液中滴加硝酸银溶液;有白色沉淀生成;AgNO3+NaCl═AgCl↓+NaNO3;
(3)所取海砂的质量和氯化银的质量.
点评 本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,明确检验离子是否存在时,一定避免排除干扰离子,确保检验方案的严密性.


科目:初中化学 来源: 题型:选择题
| A. | “能走不骑,能骑不坐,能坐不开”是低碳交通的重要理念 | |
| B. | 低碳交通的目的是节能减排,建设更加绿色、更加宜居的苏州 | |
| C. | 制造自行车轮胎的材料是塑料,它属于有机高分子材料 | |
| D. | 自行车钢圈在镀层脱落后更容易生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
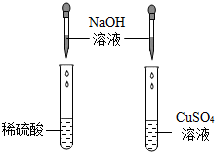 某化学兴趣小组的同学在探究碱与酸、碱反应的性质时做了如图两个实验.
某化学兴趣小组的同学在探究碱与酸、碱反应的性质时做了如图两个实验.| 实验步骤 | 实验现象 | 实验结论 |
| 取少量烧杯内的液体于试管中,并加入少量氧化铜固体 | 黑色固体溶解 | 小华观点正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有少量Fe2CO3的试管中分别加入NaCl溶液和Na2SO4溶液,振荡 | 固体不溶解 | ${SO}_{4}^{2-}$或Cl-不能使Fe2O3溶解;H2O分子不能使Fe2O3溶解 |
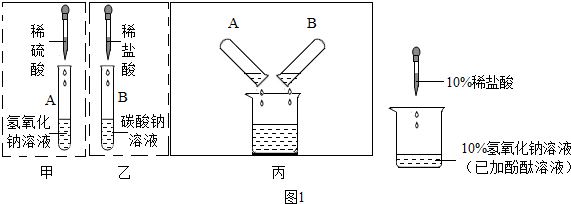
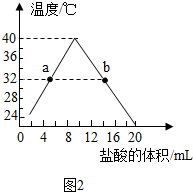
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去二氧化碳中少量的一氧化碳 | 通入氧气、点燃 |
| B | 检验氧气和二氧化碳 | 加澄清石灰水 |
| C | 验证锌、铜、金的金属活动性 | 加盐酸 |
| D | 除去生石灰中少量的碳酸钙 | 加水充分搅拌 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com