
| A. | 氟乙酸甲酯属于氧化物 | |
| B. | 氟乙酸甲酯中碳元素的质量分数约为39.1% | |
| C. | 氟乙酸甲酯分子是由3个碳原子、5个氢原子、1个氟原子、2个氧原子构成的 | |
| D. | 氟乙酸甲酯中碳、氢、氟、氧四种元素的原子个数比为36:5:19:32 |
分析 A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物.
B、根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析判断.
C、根据氟乙酸甲酯的微观构成进行分析判断.
D、根据1个氟乙酸甲酯分子的构成进行分析判断.
解答 解:A、氟乙酸甲酯是由碳、氢、氟、氧四种元素组成的化合物,不属于氧化物,故选项说法错误.
B、氟乙酸甲酯中碳元素的质量分数约为$\frac{12×3}{12×3+1×5+19+16×2}$×100%≈39.1%,故选项说法正确.
C、氟乙酸甲酯是由氟乙酸甲酯分子构成的,1个氟乙酸甲酯分子是由3个碳原子、5个氢原子、1个氟原子、2个氧原子构成的,故选项说法错误.
D、1个氟乙酸甲酯分子是由3个碳原子、5个氢原子、1个氟原子和2个氧原子构成的,则氟乙酸甲酯中碳、氢、氟、氧原子的个数比为3:5:1:2,故选项说法错误.
故选:B.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:初中化学 来源: 题型:填空题
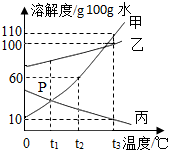 如图为甲、乙、丙三种固体物质溶解度曲线,据图回答:
如图为甲、乙、丙三种固体物质溶解度曲线,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
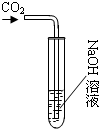 化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量酚酞 | ①产生白色沉淀 ②溶液变红 | 贝贝的猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
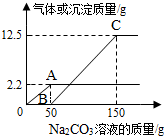 在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 铝片长度 | H+浓度相同的酸 | 反应片刻后添加少量试剂 | 产生气泡的速率 | 结论 |
| A | 2cm | 5mL | Na2SO4固体 | 无明显变化 | (结论A) |
| B | 2cm | 5mL | (试剂B) | 明显变快 | Cl-对反应有促进作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com