
甲、乙两种固体的溶解度曲线如图所示。下列说法中,正确的是( )
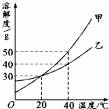
A.甲的溶解度大于乙的溶解度
B.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
C.40℃时,分别在100 g水中加入40g 甲、乙,所得溶液溶质的质量分数相等
D.分别将甲和乙的饱和溶液从40℃降低到20℃,甲会析出晶体,乙则不会
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:初中化学 来源:2016届甘肃省白银市育才学校九年级上期中化学试卷(解析版) 题型:选择题
证明一个集气瓶里盛的是氧气还是空气的简便方法是( )
A.用带火星的木条检验
B.用细铁丝能否燃烧来检验
C.用镁条燃烧来检验
D.用红磷燃烧来检
查看答案和解析>>
科目:初中化学 来源:2016年初中毕业升学考试(天津卷)化学(解析版) 题型:填空题
金属具有广泛的应用。
(1)下列金属制品中,利用金属导热性的是 (填字母)。
A.金属硬币 B.铝制导线 C.铜制火锅
(2)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是 (用化学方程式表示)。
(3)防止金属锈蚀是保护金属资源的有效途径之一。
洁净的铁钉在下列情况下容易生锈的是 (填字母)。
A.在干燥的空气中 B.在潮湿的空气中 C.浸没在植物油中
(4)铝具有良好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。氧化铝难溶于水,却能溶于酸.写出氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式 。
(5)向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液。向滤液中加一洁净铁片,未看到铁片有任何变化。则滤液中含有的溶质是 (填化学式),滤渣中一定含有的物质是 (填化学式)。
查看答案和解析>>
科目:初中化学 来源:2016年初中毕业升学考试(四川乐山卷)化学(解析版) 题型:填空题
汽车是现代生活中重要的交通工具。请回答下列问题:
(1)汽车电路中的导线一般为铜芯线,这是利用了金属铜的延展性和 性。
(2)下列制造汽车所用到的材料中,属于有机合成材料的是(填序号) 。
①钢铁 ②合成橡胶 ③羊毛织物 ④铝合金 ⑤塑料
(3)铁在潮湿的空气中容易锈蚀。汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝 和水。
(4)某汽修厂清洗汽车零件后的废液中常含有一定量的AgNO3和Cu(NO3)2。向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤液中加入稀盐酸,没有白色沉淀产生。下列叙述正确的是 (填序号)。
A.滤渣中一定没有Fe
B.滤液中一定有Fe(NO3)2和Cu(NO3)2
C. 滤渣中一定有Ag,可能有Cu
D.滤液中一定有Fe(NO3)2,一定没有AgNO3
查看答案和解析>>
科目:初中化学 来源:2016年初中毕业升学考试(四川乐山卷)化学(解析版) 题型:选择题
硒是人体必需的微量元素。在元素周期表中硒元素的某些信息如图所示,下列有关硒的说法正确的是( )

A.属于金属元素
B.原子序数为34
C.原子核内中子数为34
D.相对原子质量是78.96g
查看答案和解析>>
科目:初中化学 来源:2016年初中毕业升学考试(四川巴中卷)化学(解析版) 题型:计算题
巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源:2016年初中毕业升学考试(江苏扬州卷)化学(解析版) 题型:信息分析题
CaCO3在生产生活中有广泛的用途。
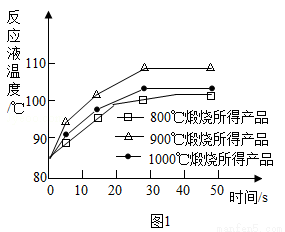
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________________。为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。可知:CaO与水反应会_____热量(填“放出”或“吸收”);上述温度中,___℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是____________。
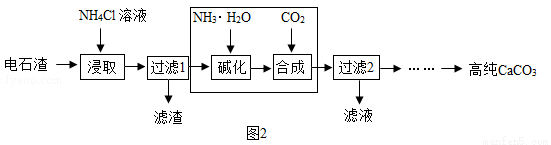
(2)以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂志]为原料制备高纯CaCO3的流程如下:
①如图3为NH4Cl浓度对钙、镁浸出率的影响(浸出率= ×100%)。
×100%)。
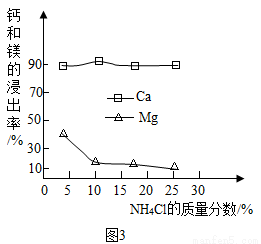
可知:较适宜的NH4Cl溶液的质量分数为_______;浸取时主要反应的化学方程式为_________________。
②流程中虚线内部分若改用______溶液(填化学式),可一步得到与原流程完全相同的生成物。
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,试从生物的角度分析原流程的优点:a.NH3可循环利用;b._______________。
查看答案和解析>>
科目:初中化学 来源:2016年初中毕业升学考试(江苏无锡卷)化学(解析版) 题型:探究题
绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ.制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物:
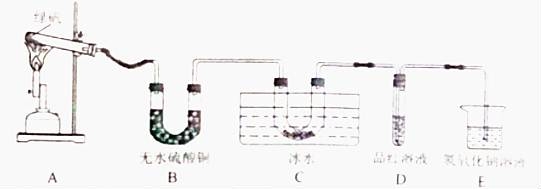
实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ.制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:

【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为:
① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)2。
由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+Fe(OH)2═Fe3O4+4H2O
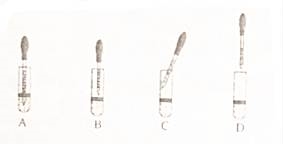
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的争取使用方法是 (填字母)。
Ⅲ.制备还原铁粉
制备还原铁粉的工业流程如下:
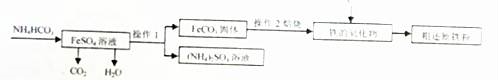
(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22g
CO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:
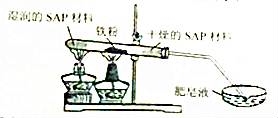
SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体 是 ,干燥的SAP材料作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com