
 已知木炭粉和氧化铜反应的化学方程为:C+2CuO
已知木炭粉和氧化铜反应的化学方程为:C+2CuO 2Cu+CO2↑
2Cu+CO2↑ =0.8g,故氧化铜中氧元素的质量分数为
=0.8g,故氧化铜中氧元素的质量分数为 ×100%=20%.故答案为:20%.
×100%=20%.故答案为:20%.

科目:初中化学 来源: 题型:
 已知木炭粉和氧化铜反应的化学方程为:C+2CuO
已知木炭粉和氧化铜反应的化学方程为:C+2CuO| 高温 |
查看答案和解析>>
科目:初中化学 来源: 题型:
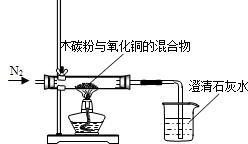
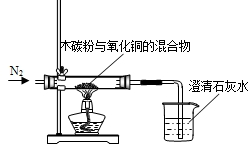
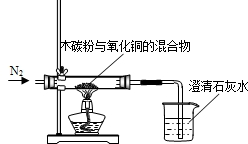
 某化学小组利用图所示的装置探究木炭粉和氧化铜反应后气体产物的成分.主要实验步骤如下:
某化学小组利用图所示的装置探究木炭粉和氧化铜反应后气体产物的成分.主要实验步骤如下:查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 高温 |
查看答案和解析>>
科目:初中化学 来源:《第5章 金属与矿物》2011年单元测试卷(5)(解析版) 题型:解答题
 2Cu+CO2↑
2Cu+CO2↑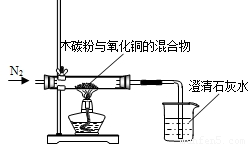
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com