
| ||
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:初中化学 来源: 题型:
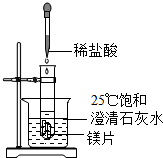 化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊.
化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊.查看答案和解析>>
科目:初中化学 来源: 题型:
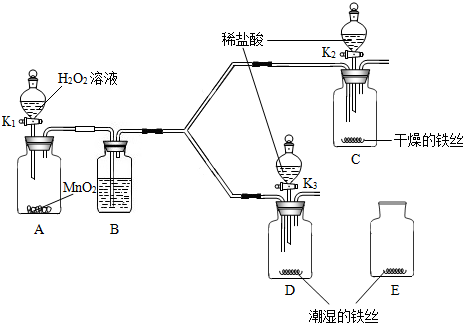
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 解释或结论 |
| (1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸. | ①通过NaOH溶液的目的是除去空气中的二氧化碳;该反应的化学方程式 ②通过浓硫酸的目的是为了除去空气中的 |
| (2)将气体通过能红热的铜 | 除尽空气中氧气的化学方程式是 |
| (3)收集剩余气体,并测定其密度 | 密度为1.2572克/升 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| 无明显现象 | 猜想3错误 | |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com