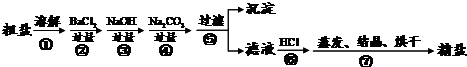
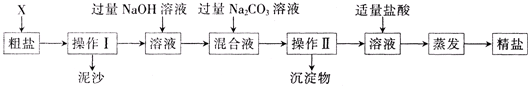
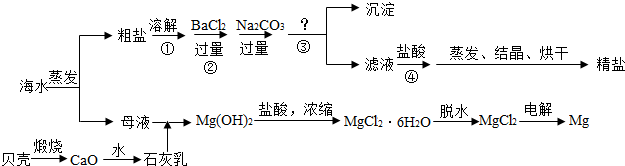
解:(1)掌握粗盐提纯的操作方法与步骤,了解蒸发是的注意事项;
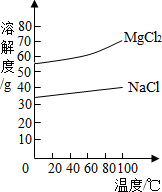
(2)由MgCl
2溶液得到MgCl
2?6H
2O也需要蒸发,根据溶解度曲线,蒸发的目的是得到热饱和溶液;
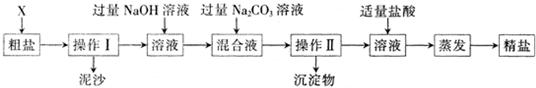
(3)掌握玻璃棒的作用,为制得精盐使用的药品及其作用目的;
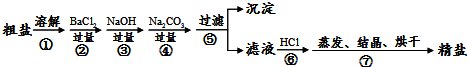
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是Cl
2、BaSO
4、BaCO
3(5)根据反应物、生成物、反应条件及物质的质量关系,书写化学方程式:4MgCl
2?6H
2O

3MgO+MgCl
2+6HCl+21H
2O
(6)有已知条件,根据化学方程式进行计算,求参加反应的氢氧化钠的质量;再求得该溶液样品中氢氧化钠的质量分数.
故答为:(1)ac;(2)得到热饱和溶液;(3)搅拌,加速溶解;Na
2SO
4;除却过量的Na
2CO
3;(4)Cl
2、BaSO
4、BaCO
3(5)4MgCl
2?6H
2O

3MgO+MgCl
2+6HCl+21H
2O、36.7%
(6)①解:设25mL该溶液样品中含氢氧化钠为x.
参加反应的硫酸质量为:49×10%=4.9克
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98
x 4.9克
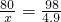
x=4克
答:25mL该溶液样品中含氢氧化钠4克.
②
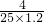
×100%≈13.3%
答:该溶液样品中氢氧化钠的质量分数是13.3%
分析:(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤:因为氯化钠的溶解度受温度影响不大,所以b.蒸发的目的是析出晶体,d.应蒸发至有较多晶体析出时为止,反之,则错误;
(2)由MgCl
2溶液得到MgCl
2?6H
2O也需要蒸发,根据溶解度曲线,蒸发的目的是得到热饱和溶液;
(3)①玻璃棒的作用;②钡离子除掉硫酸根;③盐酸除掉过多的碳酸钠;
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是Cl
2、BaSO
4、BaCO
3(5)“在550℃时,MgCl
2?6H
2O会分解生成MgO、MgCl
2、HCl和水,其中MgO、MgCl
2的物质的量之比为3:1”根据反应物、生成物、反应条件及物质的质量关系,书写化学方程式;
(6)已知“该溶液样品25mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和”,所以参加反应的硫酸质量为:49×10%=4.9克,再根据化学方程式进行计算,求参加反应的氢氧化钠的质量;再求得该溶液样品中氢氧化钠的质量分数.
点评:本题主要考查了氯化钠与粗盐提纯的方法步骤,掌握根据化学方程式计算的方法,了解有关溶质质量分数的简单计算.

 3MgO+MgCl2+6HCl+21H2O
3MgO+MgCl2+6HCl+21H2O 3MgO+MgCl2+6HCl+21H2O、36.7%
3MgO+MgCl2+6HCl+21H2O、36.7%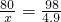
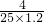 ×100%≈13.3%
×100%≈13.3%

 特高级教师点拨系列答案
特高级教师点拨系列答案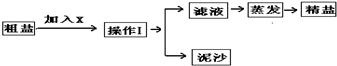
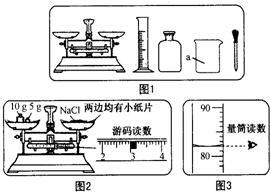 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验: