
分析 根据金属活动性顺序回答,铜、银、铁三种金属的活动性顺序是铁>铜>银,只有排在前面的金属才能把后面的金属从其盐溶液中置换出来,逐一分析四个选项,通过物质间的反应能依次证明这三种金属的活动性强弱.
解答 解:(1)将铜丝和铁丝分别放入相同的浓度的稀H2SO4中,依据铁丝表面有气泡,而铜丝表面没有 现象,可以判断Fe的活动性比Cu强;
(2)将铜丝放入AgNO3溶液中,Cu与AgNO3溶液反应生成了硝酸铜和银,反应的化学方程式为Cu+2AgNO3═Cu(NO3)2+2Ag;
(3)A、铁能和硫酸铜反应,证明铁比铜强,银和硫酸铜不反应,证明铜比银强,能证明Cu、Fe、Ag的活动性顺序.
B、银和铜都不能和硝酸亚铁反应,说明了铁的活动性大于铜、银,无法证明铜、银的活动性的强弱,故不能验证Cu、Fe、Ag的活动性顺序.
C、铁、铜和硝酸银都能反应,说明了铁、铜的活动性都大于银,无法证明铁、铜的活动性的强弱,不能证明Cu、Fe、Ag的活动性顺序.
故答为:(1)铁丝表面有气泡,而铜丝表面没有;
(2)Cu+2AgNO3═Cu(NO3)2+2Ag;
(3)A.
点评 本题从多角度考查了金属和盐溶液能否反应,充分体现了金属活动性顺序的应用.


科目:初中化学 来源: 题型:选择题
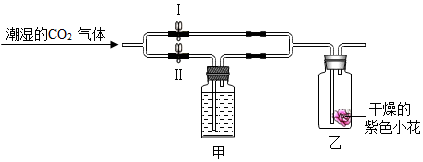
| A. | 红色、红色 | B. | 蓝色、紫色 | C. | 红色、紫色 | D. | 紫色、红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用一氧化碳冶铁:Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 置换反应 | |
| B. | 干粉灭火器原理:Ca(HCO3)2═CaCO3↓+H2O+CO2↑ 分解反应 | |
| C. | 用酒精(C2H5OH)作燃料:C2H5OH+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O 氧化反应 | |
| D. | 用稀盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O 复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 肯德基套餐是我们大家比较喜欢的一种食物.请回答下列问题
肯德基套餐是我们大家比较喜欢的一种食物.请回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
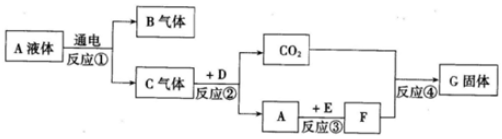
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com