
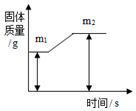
 质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.
质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.科目:初中化学 来源: 题型:选择题
| A. | 往溶液中加BaCl2溶液生成不溶于硝酸的白色沉淀,说明溶液中一定含SO42- | |
| B. | 浓硫酸能使纸张碳化变黑,说明浓硫酸具有吸水性 | |
| C. | 氯化钠晶体不导电,说明氯化钠晶体中不存在自由移动的离子 | |
| D. | 溶液中加稀盐酸,有能使澄清石灰水变浑浊的气体放出,说明溶液中有CO32- |
查看答案和解析>>
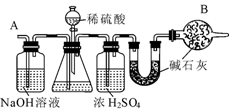
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是小柯同学在复习科学时,构建酸通性的“手掌图”.
如图是小柯同学在复习科学时,构建酸通性的“手掌图”.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 12.8g | B. | 14.6g | C. | 20g | D. | 25g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答| 温度℃ | 0 | 10 | 20 | T2 | 40 | 50 |
| 溶解度g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com