
 用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示:
用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示:分析 (1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,进行分析确定操作的过程.
(2)根据当加入溶液的质量为bg时,所加溶液过量来分析解答.
(3)根据溶质质量=溶液质量×溶质的质量分数,列式表示出当加入氢氧化钠溶液的质量为40g时溶质的质量,进而根据化学方程式计算出所得溶液中溶质的质量即可.
解答 解:(1)由图象可知,pH值是开始时小于7逐渐的增大到7然后大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH升高,说明是把氢氧化钠溶液滴加到稀盐酸中.故答案为:氢氧化钠溶液.
(2)当加入溶液的质量为bg时,所加氢氧化钠溶液过量,故溶液中的溶质有生成的氯化钠和过量的氢氧化钠;故填:NaCl和NaOH;
(3)设所得溶液中溶质的质量为x,盐酸中溶质质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
40g×10% y x
$\frac{40}{58.5}=\frac{40g×10%}{x}$,$\frac{40}{36.5}=\frac{40g×10%}{y}$
x=5.85g y=3.65g
稀盐酸溶液的质量分数=$\frac{3.65g}{50g}×100%$=7.3%
答:稀盐酸溶液的质量分数为7.3%,所得溶液中溶质的质量为5.85g.
点评 本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 28.6% | B. | 25.6% | C. | 26.5% | D. | 40% |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
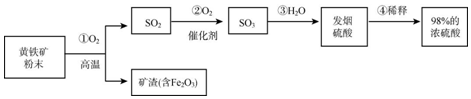
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 所有试剂 |
| A | H2 | HCl | NaOH溶液 |
| B | SO2 | H2O | 碱石灰 |
| C | CaO | CaCO3 | 适量的稀盐酸 |
| D | NaOH | Na2CO3 | 适量的BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
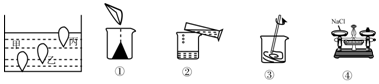
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 把镍浸入稀硫酸中 | (1)产生气泡,溶液由无色变成绿色 | 镍的活动性比氢强 |
| 把镍浸入硫酸亚铁溶液中 | 无明显现象 | 镍的活动性比铁(2)弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com