
 人类的生产、生活离不开金属.
人类的生产、生活离不开金属.分析 (1)根据元素周期表的信息可知,铁原子的相对原子质量为55.85进行解答;
(2)根据铁生锈的条件进行解答;
(3)根据工业上用赤铁矿(主要成分是Fe2O3)炼铁,其主要反应原理一氧化碳和氧化铁反应生成铁和二氧化碳进行解答.
解答 解:(1)根据元素周期表的信息可知,铁原子的相对原子质量为55.85;故填:55.85;
(2)根据铁生锈的条件可知,铁在空气中生锈,实际上是铁跟氧气、水等物质作用的结果;故填:氧气、水;
(3)工业上用赤铁矿(主要成分是Fe2O3)炼铁,其主要反应原理一氧化碳和氧化铁反应生成铁和二氧化碳,化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 了解元素周期表的特点及其应用、铁生锈的条件、工业炼铁的原理是解题的关键,属于基础知识的考查.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验序号 | 10%的H2O2 溶液(mL) | 溶液中加入 物质(g) | 收集到气体的 体积(mL) |
| 1 | 100 | 无 | a |
| 2 | 100 | Fe2O30.5g | b |
| 3 | 100 | MnO20.5g | c |
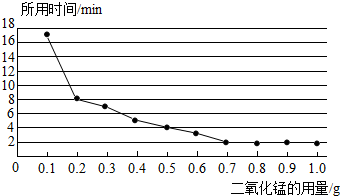
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 稀盐酸的质量 | 第一次 40g | 第二次 40g | 第三次 40g | 第四次 40g | 第五次 40g |
| 剩余固体质量 | 40.0g | 30.0g | 20.0g | 10.0g | 5.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酒精与水--观察颜色 | B. | 氧气与二氧化碳气体--燃着的木条 | ||
| C. | 水与澄清石灰水--二氧化碳气体 | D. | 空气与氧气--带火星的木条 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠、食盐、NaCl | B. | 氢氧化钠、火碱、NaOH | ||
| C. | 碳酸钠、苏打、Na2CO3 | D. | 氢氧化钙、生石灰、CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | CO2 | 水蒸气 | 通入浓硫酸中 |
| B | KCl溶液 | K2CO3 | 加适量稀盐酸 |
| C | CaO | CaCO3 | 加水、过滤 |
| D | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com