6.兴趣小组分析了用硫铁矿烧渣(主要成份Fe
2O
3、Fe
3O
4、FeO等)制备铁红(Fe
2O
3) 的流程图并进行了铁红性质实验.
一、铁红制备的流程图分析
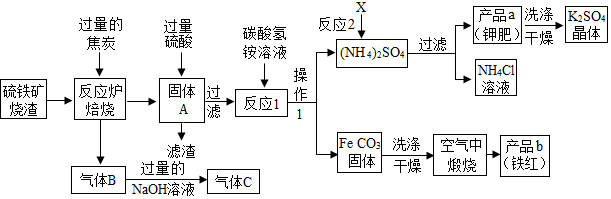
(1)气体B中的成分是二氧化碳和一氧化碳
(2)你认为对气体C最佳的处理方法是C.
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
(3)反应1的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵分解.
(4)洗涤K
2SO
4晶体时,可选用下列C(填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K
2SO
4的饱和溶液
为检验K
2SO
4晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO
3)
2溶液,
振荡、静置,再向上层清液中加入AgNO
3溶液,观察现象即可判断.
二、铁红的性质实验
【资料1】草酸晶体(H
2C
2O
4•3H
2O)在浓H
2S0
4作用下受热分解,化学方程式为:
H
2C
2O
4•3H
2O $\frac{\underline{\;浓硫酸\;}}{\;}$ CO
2↑+CO↑+4H
2O
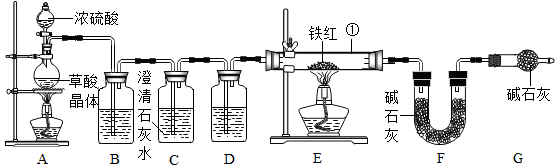
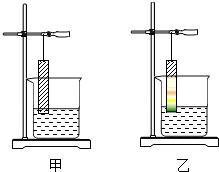
(5)A、E两处酒精灯点燃的先后顺序是先点燃A处,后点燃E处
(6)C装置的作用是检验二氧化碳气体是否除净.
(7)该装置的缺陷是没有处理尾气.
【数据分析与计算】用SDTQ600热分析仪对氧化铁(Fe
2O
3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如下图.
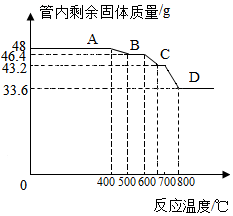
【资料2】已知铁的氧化物有:FeO、Fe
3O
4、Fe
2O
3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁.
(8)800℃以上时,管内固体成分的化学式为Fe;
(9)通过计算写出管内固体质量由48g变为46.4g时反应的化学方程式3Fe
20
3+C0$\frac{\underline{\;高温\;}}{\;}$2Fe
30
4+C0
2.计算过程:解:设管内固体的化学式为Fe
xO
y,
48g氧化铁中铁元素质量为:48g×$\frac{112}{160}$×100%=33.6g,
氧元素质量为:48g-33.6g=14.4g,
根据题意有:$\frac{33.6g}{46.4g}$=$\frac{56x}{56x+16y}$,
$\frac{x}{y}$=$\frac{3}{4}$,
即46.4g固体是四氧化三铁,即氧化铁和一氧化碳反应生成四氧化三铁和二氧化碳.

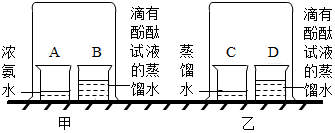



 菠菜是一种营养价值很高的蔬菜.小明同学为了研究菠菜汁的成份,进行如下实验:
菠菜是一种营养价值很高的蔬菜.小明同学为了研究菠菜汁的成份,进行如下实验: