
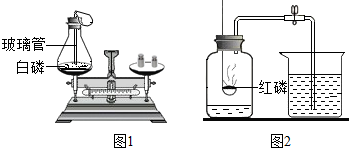
 如图进行试验,请按要求填空.
如图进行试验,请按要求填空.分析 (1)根据质量守恒定律可知反应前后各物质的质量相等进行解答;
(2)根据红磷燃烧消耗氧气,同时生成五氧化二磷固体进行解答.
解答 解:(1)质量守恒定律可知反应前后各物质的质量相等,所以图1进行的实验,称量白磷燃烧前后(装置冷却至室温)的质量,天平的变化是仍然保持平衡;此实验目的是验证质量守恒定律;
故填:仍然保持平衡;验证质量守恒定律;
(2)红磷燃烧消耗氧气,同时生成五氧化二磷固体,集气瓶内的压强变小,所以烧杯中的水倒流至瓶中,进入水的体积就是集气瓶中氧气的体积.故填:测定空气中氧气的含量;红磷燃烧消耗氧气,同时生成五氧化二磷固体,集气瓶内的压强变小.
故答案为:
(1)仍然保持平衡;验证质量守恒定律;
(2)测定空气中氧气的含量;红磷燃烧消耗氧气,同时生成五氧化二磷固体,集气瓶内的压强变小.
点评 此题考查质量守恒定律以及空气中氧气的含量的测定实验,在化学反应中遵循质量守恒定律,参加反应的物质的质量等于反应后生成的物质的质量.


科目:初中化学 来源: 题型:解答题
 现有一瓶未开封的浓硫酸,部分标签如图所示,根据这些数据回答下列问题.
现有一瓶未开封的浓硫酸,部分标签如图所示,根据这些数据回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 玻璃杯摔碎,米饭变馊 | B. | 菜刀生锈,牛奶变酸 | ||
| C. | 乒乓球变瘪,蜡烛燃烧 | D. | 酒精挥发,湿衣服晾干 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 鉴别的物质 | 鉴别额的方法 |
| A | 冰和干冰 | 常温放置一段时间,观察现象 |
| B | 水和过氧化氢溶液 | 分别加二氧化锰,观察现象 |
| C | 一氧化碳和二氧化碳 | 分别通入澄清石灰水,观察现象 |
| D | 二氧化锰和氧化铜 | 观察颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH溶液+HCl溶液 | B. | NaOH溶液+CuSO4溶液 | ||
| C. | Ca(OH)2溶液+Na2CO3溶液 | D. | Na2CO3溶液+H2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com