
分析 (1)根据水是由氢氧元素组成的分析.
(2)根据分子、原子和离子是构成物质的三种微粒,多数物质由分子构成,金属单质、稀有气体、金刚石、石墨等由原子直接构成,酸碱盐由离子构成分析.
(3)①根据甲烷燃烧生成二氧化碳和水,释放热量分析.
②A、从反应前后元素种类不变只能得出甲中一定含有碳、氢,可能含氧元素分析.
B、根据质量守恒定律求出参加反应的物质甲的质量,然后根据一氧化碳、二氧化碳和水的化学式求出各化合物中元素的质量分数,根据质量守恒定律三种生成物质中氧元素的质量和大于消耗6.4g氧气,说明物质甲中含有氧元素;
C、用质量乘以化合物中碳元素的质量分数即化合物中碳的质量,一氧化碳和二氧化碳中碳元素都来自物质甲,求出来后比上参加反应的物质甲的质量即为甲中碳元素的质量分数;
D、根据上面的数据结合甲的相对分子质量求出甲分子中碳氢氧原子个数比,甲和氧气反应生成二氧化碳和水时反应的质量比即可求出从而可以解答D.
解答 解:(1)水是由氢氧元素组成,故答案:氢、氧(或H、O)元素;
(2)分子、原子和离子是构成物质的三种微粒,多数物质由分子构成,金属单质、稀有气体、金刚石、石墨等由原子直接构成,酸碱盐由离子构成,故答案:分子、原子和离子;分子;
(3)①甲烷燃烧生成二氧化碳和水,释放热量,故答案:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O; 热;
②A、从反应前后元素种类不变只能得出甲中一定含有碳、氢,可能含氧元素,A说法不正确.
B、5.6g一氧化碳中氧元素的质量为5.6g×$\frac{16}{28}$×100%=3.2g,4.4g二氧化碳中氧元素的质量为4.4g×$\frac{32}{44}$×100%=3.2g,5.4g水中氧元素的质量为5.4g×$\frac{16}{18}$×100%=4.8g,根据质量守恒定律反应前后氧元素的质量不变,反应后氧元素的总质量为3.2g+3.2g+4.8g=11.2g>6.4g,所以反应物甲中含有氧元素,氧元素的质量为11.2g-6.4g=4.8g.B说法不正确.
C、5.6g一氧化碳中碳元素的质量为5.6g×$\frac{12}{28}$×100%=2.4g,4.4g二氧化碳中碳元素的质量为1.2g,所以生成物中碳元素一共3.6g,根据质量守恒定律这与参加反应的甲中碳元素的质量相等,所以甲中碳元素的质量分数为$\frac{3.6g}{9g}$×100%=40%,C正确.
D、设甲的化学式为CxHyOz,则$\frac{12x}{90}$×100%=40%,x=3;氧元素的质量分数为$\frac{16z}{90}$=$\frac{4.8g}{9g}$,z=3;根据甲的相对分子质量12×3+y+16×3=90,z=6;所以甲的化学式为C3H6O3,燃烧的化学方程式为C3H6O3+3O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+3H2O,所以甲和氧气反应生成二氧化碳和水时甲和氧气的质量比为90:96,所以D说法正确;故选CD.
点评 本题考查了物质的组成、构成,酸碱指示剂、化学方程式的书写和质量守恒定律的相关知识,注重计算能力的考查.


科目:初中化学 来源: 题型:选择题
| A. | 空气是由多种物质组成的混合物 | B. | 空气是一种重要的自然资源 | ||
| C. | 空气中氧气的质量分数约为21% | D. | 空气中含有多种不同的分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
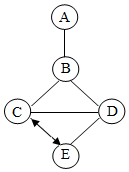 已知A、B、C、D、E分别是氧化铁、盐酸、氢氧化钙、碳酸钠和二氧化碳中的一种,图中“-”表示二者可以发生反应,“?”两种物质可以通过化学反应相互转化,请回答:
已知A、B、C、D、E分别是氧化铁、盐酸、氢氧化钙、碳酸钠和二氧化碳中的一种,图中“-”表示二者可以发生反应,“?”两种物质可以通过化学反应相互转化,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO32-Na + Cl- NO3- | B. | SO42- Cu2+ H+ Cl- | ||
| C. | Ca2+ CO32-Cl- NH4+ | D. | OH-SO42- Na + Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com