
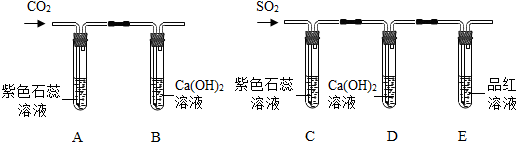
分析 (1)根据二氧化硫能与石灰水反应生成白色的亚硫酸钙的知识解决;
(2)依据二氧化硫是有毒气体,需进行尾气处理的知识分析判断;
【反思提高】根据二氧化硫的漂白原理进行分析判断即可.
解答 解:(1)①结合题干中的叙述可知:二氧化硫能与石灰水反应生成白色的亚硫酸钙和水,其方程式为:SO2+Ca(OH)2═CaSO3↓+H2O;因为氢氧化钠易溶于水,氢氧化钙微溶于水或等质量的饱和溶液中氢氧化钠含量多,所以吸收二氧化碳时常用氢氧化钠溶液.
(2)二氧化硫是有毒气体,不能排放到空气中污染空气,所以该装置需进行尾气处理以防空气污染;
【反思提高】二氧化硫的漂白原理是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,所以可进行如下设计:将褪色的溶液加热,观察溶液颜色的变化,若溶液恢复为原来的颜色,则结论正确,否则错误.
故答案为:
(1)SO2+Ca(OH)2═CaSO3↓+H2O;等质量的饱和溶液中氢氧化钠含量多,所以吸收二氧化碳时常用氢氧化钠溶液;
(2)没有进行尾气处理;
【反思提高】将褪色后的溶液加热,观察溶液颜色变化,若溶液恢复为紫色,则此结论是正确的;若溶液不能恢复为紫色,则此结论不正确.
点评 此题是一道实验设计题,解题的关键是掌握二氧化碳的性质并进行知识的大胆迁移,只有这样才能顺利解题.


 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
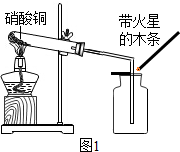 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用图1装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用图1装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.| 实验操作 | 实验现象 | 实验结论 |
| 步骤Ⅰ:将反应后试管中的固体加水充分溶解,过滤,洗涤, 向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤Ⅱ:在图1的试管和集气瓶之间连图2所示的装置,重新进行加热硝酸铜的实验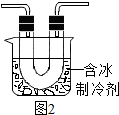 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 实验事实 | 影响化学反应的因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气反应,而在点燃时能与氧气反应 | 反应温度 |
| C | 大块木头不易点燃,而刨成非常薄的片状却易点燃 | 反应物的种类 |
| D | 双氧水在常温下缓慢分解,而在加入二氧化锰后迅速分解 | 有、无催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4% | B. | 2% | C. | 8% | D. | 无法计算 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeCl3、KOH、NaCl | B. | K2SO4、BaCl2、HCl | ||
| C. | CuSO4、HCl、KCl | D. | Na2CO3、KCl、Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com