
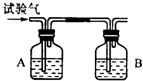
 CH4”¢H2ŗĶCO£Ø¼ņ³ĘŹŌŃéĘų£©ČżÖÖæÉČ¼ŠŌĘųĢ壬æÉ·Ö±šČĆĖūĆĒŌŚŃõĘųÖŠČ¼ÉÕ£¬°ŃČ¼ÉÕŗóÉś³ÉµÄĘųĢåŅĄ“ĪĶعżA”¢BĮ½øöĻ“ĘųĘ森»Ų“šĻĀĮŠĪŹĢā£ŗ
CH4”¢H2ŗĶCO£Ø¼ņ³ĘŹŌŃéĘų£©ČżÖÖæÉČ¼ŠŌĘųĢ壬æÉ·Ö±šČĆĖūĆĒŌŚŃõĘųÖŠČ¼ÉÕ£¬°ŃČ¼ÉÕŗóÉś³ÉµÄĘųĢåŅĄ“ĪĶعżA”¢BĮ½øöĻ“ĘųĘ森»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö CH4Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬H2Č¼ÉÕÉś³ÉĖ®£¬COČ¼ÉÕÉś³É¶žŃõ»ÆĢ¼£»ÅØĮņĖįæÉĪüŹÕĖ®·Ö£¬ÖŹĮæŌö¼Ó£¬NaOHČÜŅŗæÉŅŌĪüŹÕ¶žŃõ»ÆĢ¼£¬ÖŹĮæŌö¼Ó£®
½ā“š ½ā£ŗ£Ø1£©Čē¹ūĘųĢåĻČĶعżĒāŃõ»ÆÄĘČÜŅŗ£¬µ±ĘųĢåĶعżĒāŃõ»ÆÄĘČÜŅŗŹ±»į“ų³ö²æ·ÖĖ®ÕōĘų£¬µ¼ÖĀ²āĮæ²»×¼Č·£¬ĖłŅŌÓ¦øĆĻČĶعżÅØĮņĖįŌŁĶعżĒāŃõ»ÆÄĘČÜŅŗ£¬ĖłŅŌAŹĒÅØĮņĖį£¬BŹĒĒāŃõ»ÆÄĘČÜŅŗ£®
¹Ź“š°øĪŖ£ŗÅØĮņĖį£»ĒāŃõ»ÆÄĘČÜŅŗ£»
£Ø2£©Čō×°ÖĆAµÄÖŹĮæŌö¼Ó£¬BµÄÖŹĮæ²»±ä£¬ŌņĖµĆ÷øĆĘųĢåČ¼ÉÕŗóֻɜ³ÉĖ®£¬ĖłŅŌŹĒĒāĘų£¬·“Ó¦ĪļŹĒĒāĘųŗĶŃõĘų£¬Éś³ÉĪļŹĒĖ®£¬ÓĆ¹Ū²ģ·ØÅäĘ½¼“æÉ£¬ĖłŅŌ·½³ĢŹ½ŹĒ£ŗ2H2+O2$\frac{\underline{\;µćČ¼\;}}{\;}$2H2O£®
¹Ź“š°øĪŖ£ŗĒāĘų£»2H2+O2$\frac{\underline{\;µćČ¼\;}}{\;}$2H2O
£Ø3£©Čō×°ÖĆAÖŹĮæ²»±ä£¬BµÄÖŹĮæŌö¼Ó£¬ĖµĆ÷øĆĘųĢåČ¼ÉÕŗóֻɜ³É¶žŃõ»ÆĢ¼£¬ĖłŅŌŹĒŅ»Ńõ»ÆĢ¼£®·“Ó¦ĪļŹĒ¶žŃõ»ÆĢ¼ŗĶĒāŃõ»ÆÄĘ£¬Éś³ÉĪļŹĒĢ¼ĖįÄĘŗĶĖ®£¬ĖłŅŌ·½³ĢŹ½ŹĒ£ŗ2NaOH+CO2=Na2CO3+H2O£»
¹Ź“š°øĪŖ£ŗŅ»Ńõ»ÆĢ¼£»2NaOH+CO2=Na2CO3+H2O£»
£Ø4£©Čō×°ÖĆA”¢BµÄÖŹĮ涼Ōö¼Ó£¬ĖµĆ÷øĆĘųĢåČ¼ÉÕŗóÉś³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬ĖłŅŌøĆĘųĢåŹĒ¼×Ķ飬BÖŹĮæŌö¼ÓµÄĮæŹĒ¶žŃõ»ÆĢ¼£¬2.2g¶žŃõ»ÆĢ¼ÖŠŗ¬ÓŠĢ¼ŌŖĖŲµÄÖŹĮæĪŖ£ŗ2.2”Į$\frac{12}{44}”Į100%$=0.6g£»¼×ĶéÖŠĢ¼ŌŖĖŲÓėĒāŌŖĖŲµÄÖŹĮæ±ČŹĒ£ŗ12£ŗ4=3£ŗ1£¬ĖłŅŌĒāŌŖĖŲÖŹĮæĪŖ£ŗ0.2g£¬ĖłŅŌÉś³ÉĖ®µÄÖŹĮæĪŖ£ŗ$\frac{0.2g}{\frac{1”Į2}{18}”Į100%}$=1.8g
¹Ź“š°øĪŖ£ŗ£Ø1£©ÅØH2SO4£¬NaOH»ņCa£ØOH£©2£»£Ø2£©H2£»2H2+O2$\frac{\underline{\;µćČ¼\;}}{\;}$2H2O£Ø3£©CO£¬2NaOH+CO2=Na2CO3+H2O »ņCa£ØOH£©2+CO2=CaCO3”ż+H2O £Ø4£©CH4£¬1.8£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹµÄ¼ģŃé¼°ĪüŹÕ£¬Ć÷Č·ĪļÖŹµÄŠŌÖŹŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢ŅāĘųĢåĪüŹÕµÄĻČŗóĖ³Šņ£¬ĪŖŅדķµć£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
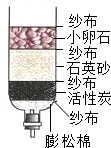
| A£® | øĆ¾»Ė®Ę÷æÉŅŌ½µµĶ×ŌĄ“Ė®µÄÓ²¶Č | B£® | øĆ¾»Ė®Ę÷ÖŠµÄ»īŠŌĢæĘšĪüø½×÷ÓĆ | ||
| C£® | øĆ¾»Ė®Ę÷ÄÜĘšµ½É±¾śĻū¶¾µÄ×÷ÓĆ | D£® | øĆ¾»Ė®Ę÷æɽ«×ŌĄ“Ė®±äĪŖÕōĮóĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįŃĪÓėŃĪĖį·“Ó¦·Å³öĘųĢ壬ĖłŅŌÄÜÓėŃĪĖį·“Ó¦·Å³öĘųĢåµÄĪļÖŹŅ»¶ØŹĒĢ¼ĖįŃĪ | |
| B£® | ÖŠŗĶ·“Ӧɜ³ÉĮĖŃĪŗĶĖ®£¬ĖłŅŌÉś³ÉŃĪŗĶĖ®µÄ·“Ó¦Ņ»¶ØŹĒÖŠŗĶ·“Ó¦ | |
| C£® | Ńõ»Æ·“Ó¦ŹĒĪļÖŹÓėŃõ·¢ÉśµÄ·“Ó¦£¬ĖłŅŌĪļÖŹÓėŃõĘųµÄ·“Ó¦Ņ»¶ØŹĒŃõ»Æ·“Ó¦ | |
| D£® | µ„ÖŹŹĒÖ»ŗ¬ÓŠŅ»ÖÖŌŖĖŲµÄ“æ¾»Īļ£¬ĖłŅŌÖ»ŗ¬ÓŠŅ»ÖÖŌŖĖŲµÄĪļÖŹŅ»¶ØŹĒµ„ÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃéŠņŗÅ | ¹żŃõ»ÆĒāČÜŅŗÅضČ/% | ¹żŃõ»ÆĒāČÜŅŗÖŹĮæ/g | ĪĀ¶Č/”ę | ¶žŃõ»ÆĆĢÓĆĮæ/g | ŃõĘųĢå»ż/ml | ·“Ó¦ĖłŠčŹ±¼ä/s |
| ¢Ł | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ¢Ś | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ¢Ū | 30 | 12 | 40 | / | 125 | 148 |
| ¢Ü | 30 | 12 | 90 | / | 125 | 82 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹµŃéæŖŹ¼Ź±£¬Ó¦ĻČ¼ģ²é×°ÖƵÄĘųĆÜŠŌŌŁ¼ÓČėŅ©Ę· | |
| B£® | ¼ÓČČŹ±£¬ĻČŌ¤ČČ£¬ŌŁ¶Ō×¼Ņ©Ę·²æĪ»¼ÓČČ | |
| C£® | ŹÕ¼ÆĘųĢåŹ±£¬Ļȵȵ¼¹ÜæŚĘųÅŻĮ¬Šų¾łŌČ·Å³öŌŁŹÕ¼Æ | |
| D£® | ¼ģ²é×°ÖĆĘųĆÜŠŌŹ±£¬ĻČÓĆŹÖ½ōĢłŹŌ¹ÜĶā±Ś£¬ŌŁ°Ńµ¼¹ÜµÄĮķŅ»¶ĖÉģČėĖ®ÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ÅØĮņĖį 500ŗĮÉż | |
| ČÜÖŹµÄÖŹĮæ·ÖŹż | 98% |
| ĆÜ¶Č | 1.84æĖ/ĄåĆ×3 |
| ĒæøÆŹ“ŠŌ£¬ŅõĄä£¬ĆÜ·ā“¢²Ų | |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com