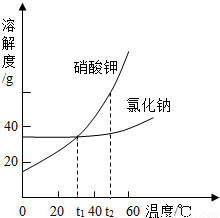
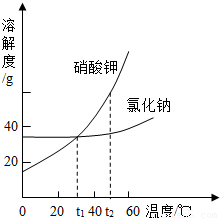
t1°C时,将2.8g生石灰加入到60g a%的饱和石灰水中,保持温度不变,所得的溶液中说法正确的是( )
A.溶液质量大于60g
B.溶液中溶质的质量分数大于a%
C.溶液中溶质的质量为0.6ag
D.若将该溶液的温度升到t2°C,所得溶液中溶质的质量分数小于a%
【答案】分析:向饱和石灰水中加入生石灰后,生石灰要和水反应:CaO+H2O═Ca(OH)2,水减少,因为温度不变,溶解度不变,溶剂减少,溶质析出,所以溶质溶剂质量减少,溶液浓度和溶解度不变,氢氧化钙的溶解度随着温度的升高而降低,可以据此来完成解答.
解答:解:A、生石灰和水反应要消耗一定质量的水,从而会使饱和石灰水中的氢氧化钙析出,从而使溶液的质量减少,故A说法不正确;
B、由于温度不变,所以氢氧化钙的溶解度也不变,由于在同一温度下,同种物质的饱和溶液的质量分数相等,所以所得溶液中溶质的质量分数不变,仍为a%,故B说法不正确;
C、在没有加入生石灰之前溶液中溶质的质量为:60g×a%=0.6a,但是加入了生石灰要消耗一部分水,从而导致原溶液中的氢氧化钙析出,所以所得溶液中溶质的质量要小于0.6ag,故C说法不正确;
D、氢氧化钙的溶解度随温度的升高而减小,所以将该溶液升高温度后,由于氢氧化钙的溶解度减小而使饱和石灰水的溶质的质量分数减小,即小于a%,故D说法正确.
故选D.
点评:知道温度是影响固体物质溶解度的唯一因素,记住氢氧化钙的溶解度随温度的升高而降低,同时知道温度不变时同种物质的饱和溶液的质量分数相等,这与溶液的质量无关.



 名校课堂系列答案
名校课堂系列答案