
| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.315g |
| 第2次加入5g | 0.63g |
| 第3次加入5g | 0.40g |
| 第4次加入5g | 0.40g |
分析 (1)由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水,因此由表中每次加入5g稀盐酸固体减少的质量关系可判断:每加入5g稀盐酸固体应减少0.685g;据此规律,由第四次加入盐酸后固体质量的减少值小于0.685g可判断此次反应后碳酸钙已完全反应;
(2)利用样品杂质的质量,由此求出石灰石样品中碳酸钙的质量分数;
(3)根据碳酸钙高温下分解反应的化学方程式,确定分解的碳酸钙与放出二氧化碳的质量关系,可由石灰石中碳酸钙的质量计算求出能得到氧化钙的质量,最后用氧化钙的质量加上100kg这种纯度的石灰石中杂质的质量即可.
解答 解:(1)根据表中的实验数据可得,每加入5g稀盐酸,固体质量减少0.685g,第三次加入稀盐酸后,固体减少的质量=0.63g-0.40g=0.23g,小于0.685g,即此时碳酸钙已完全反应;所以剩余的0.40g固体即为杂质的质量;故答案为:0.40g;
(2)石灰石样品中碳酸钙的质量分数=$\frac{2g-0.40}{2g}×100%$=80%;
(3)设能得到氧化钙的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56
100kg×80% x
$\frac{100}{56}=\frac{100kg×80%}{x}$
解得:x=44.8g
得到固体的质量为:44.8g+$\frac{0.4g×100kg}{2g}$=64.8kg
答:(2)石灰石样品中CaCO3的质量分数是80%;
(2)100kg这种纯度的石灰石充分煅烧后,可得到固体64.8kg.
点评 根据图表中剩余固体的质量,分析每次加入相同稀盐酸所减少的质量即样品中被反应掉碳酸钙的质量,判断出第四次加稀盐酸后碳酸钙完全反应,此为本题的突破口.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
 如图3个实验都与铁的性质有关,请回答相关问题.
如图3个实验都与铁的性质有关,请回答相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 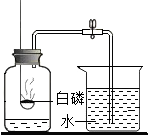 研究空气中氧气含量 | B. |  研究分子的运动 | ||
| C. | 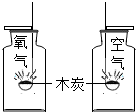 研究木炭在氧气中燃烧 | D. | 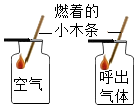 研究空气和呼出气体中氧气的含量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 阅读下面科普短文(原文作者:许谦,有删改)
阅读下面科普短文(原文作者:许谦,有删改)| 温度/℃ 时间/天 酸度/°T | 4 | 28 | 37 |
| 0 | 67.7 | 67.7 | 67.7 |
| 2 | 73.9 | 77.1 | 79.2 |
| 4 | 76.4 | 82.7 | 86.3 |
| 6 | 85.5 | 92.2 | 98.9 |
| 8 | 90.2 | 98.7 | 113.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 请回忆课堂上与同学们讨论的下列问题:
请回忆课堂上与同学们讨论的下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.
用如图所示装置研究白磷和氧气的反应,装置中试管内液面与试管外相平.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com