考点:氧气的制取装置,氧气的收集方法,氧气的检验和验满,催化剂的特点与催化作用,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见气体的实验室制法、检验、干燥与净化
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
利用加热的方法制取气体,并且利用排水法收集气体时,要按照一定的步骤进行,特别是要注意集满气体后的操作顺序,以防发生安全事故;
氧气能够支持燃烧,能使带火星的木条复燃;
(3)对比试验要严格控制变量和因变量;
(4)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气.
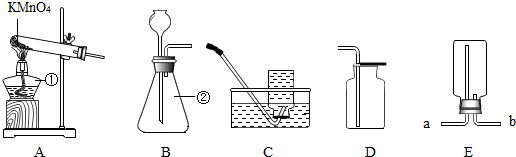
解答:解:(1)①是酒精灯,常用作热源;②是锥形瓶,常用作反应容器.
故填:酒精灯;锥形瓶.
(2)若用A装置制取氧气,发生装置应做的改进是在试管口塞一团棉花,该反应的化学方程式为:2KMnO
4K
2MnO
4+MnO
2+O
2↑;
选择C收集氧气的最佳时机是气泡均匀、连续地冒出时;
实验结束,停止加热时要先把导管移出水面,其理由是能够防止水倒流入试管时把试管炸裂;
用E装置收集氧气时,检验氧气是否收集满的方法是:把带火星的木条放在a导管口,如果带火星的木条复燃,说明已经收集满;
解:设反应后氧元素的质量为x,
6.32g高锰酸钾中,锰元素的质量为:6.32g×
×100%=2.2g,
氧元素的质量为:6.32g×
×100%=2.56g,
剩余物中锰和氧的原子个数比为2:7时,锰元素和氧元素的质量比为:(55×2):(16×7)=55:56,
反应前后锰元素的质量不变,则有:55:56=2.2g:x,
x=2.24g,
则加热过程中产生氧气的质量为:2.56g-2.24g=0.32g,
故填:0.32;
(3)该实验不恰当的地方有:催化剂不同,催化剂的质量不同,过氧化氢热源的浓度不同,通过该实验不能得出温度越高,过氧化氢溶液分解越快的结论.
故填:催化剂的质量不同;过氧化氢溶液的浓度不同.
(4)解设需要氯酸钾的质量为x,生成氯化钾的质量y,
2KClO
32KCl+3O
2↑,
245 149 96
x y 9.6g
=
=
,
x=24.5g,y=14.9g,
反应结束后残留固体质量为:5g+14.9g=19.9g,
答:若用5g二氧化锰跟氯酸钾混合加热制取9.6g的氧气,至少需要24.5g的氯酸钾,反应结束后残留固体质量至少有19.9g.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.



 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案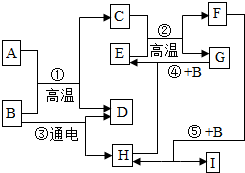 如示某些物质间转化关系.其中A、E、G为固体,且A、G均为单质,E为红棕色固体,G为常见金属;C、F、D、H为无色气体,其中C、F是由相同元素组成的无色气体,且C有毒;B为常见的无色液体,I为有机物.请回答下列问题:
如示某些物质间转化关系.其中A、E、G为固体,且A、G均为单质,E为红棕色固体,G为常见金属;C、F、D、H为无色气体,其中C、F是由相同元素组成的无色气体,且C有毒;B为常见的无色液体,I为有机物.请回答下列问题: