1:2 1:2 11:14 分子的构成不同 30g D
分析:①根据CO
2与CO含有相同的氧元素,即含有相同的氧原子数,进行分析解答;
②物质的结构决定物质的性质,进行分析解答;
③由题意“测得某CO与CO
2的混合气体中,氧元素的质量分数为64%”,而碳元素的质量分数为1-64%=36%,则可求该混合气体10g中的碳元素的质量;根据质量守恒定律的元素守恒,“将该混合气体10g通过足量灼热的氧化铁后”,碳元素都会转化为二氧化碳中,故可求二氧化碳的质量,则根据二氧化碳与氢氧化钙溶液反应的化学方程式,可求碳酸钙的质量.
④要计算含有的另一种杂质,可以根据极值法先计算10g纯碳酸钙能生成的二氧化碳的质量,然后根据平均值法确定另一种杂质.
解答:①根据CO
2与CO含有相同的氧元素,即含有相同的氧原子数,则分子数比为1:2,碳元素质量比为1:2,CO
2与CO质量比为 44:56=11:14;
故答案为:1:2; 1:2; 11:14;
②物质的结构决定物质的性质,因此一氧化碳、二氧化碳的化学性质决定于CO分子、CO
2分子的结构;所以CO
2与CO化学性质不同的主要原因是:分子的构成不同;
故答案为:分子的构成不同;
③由题意“测得某CO与CO
2的混合气体中,氧元素的质量分数为64%”,而碳元素的质量分数为1-64%=36%,则混合气体10g中的碳元素的质量:10g×36%=3.6g;
根据质量守恒定律的元素守恒,“将该混合气体10g通过足量灼热的氧化铁后”,碳元素都会转化为二氧化碳中,故可求二氧化碳的质量:3.6g÷

×100%=13.2g.
设所得二氧化碳通入足量的澄清石灰水中,最多可得白色沉淀的质量为x.
Ca(OH)
2+CO
2=H
2O+CaCO
3↓
44 100
13.2g x
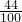
=
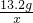
解得 x=30g.
④设10g纯碳酸钙能生成二氧化碳的质量是x,则有
CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
100 44
10g x
100:10g=44:x 解得 x=4.4g
现在不纯的碳酸钙得到4.5g二氧化碳,根据平均值法,所含有杂质应符合相同质量的杂质与盐酸反应比等质量CaCO
3与盐酸反应生成的CO
2更多的要求;结合选项中四种碳酸盐的组成特点,即所含杂质的相对分子质量应当小于CaCO3;判断所混有的杂质为碳酸镁;
故选D.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 ×100%=13.2g.
×100%=13.2g.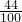 =
=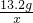 解得 x=30g.
解得 x=30g.

