
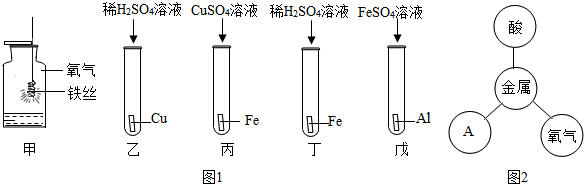
分析 (1)根据铜的性质和用途分析;
(2)根据Cu、Fe、Ag三种金属的活动性分析回答;
(3)要证明三种金属的活动性强弱,可采用金属和盐溶液反应,在金属活动性顺序表中只有前面的金属可以把排在它后面的金属从盐溶液中置换出来.
解答 解:(1)用铜做导线主要是利用铜具有良好的导电性;
(2)Cu、Fe、Ag三种金属中,能与稀盐酸发生置换反应的是Fe;反应的化学方程式:Fe+2HCl═FeCl2+H2↑;
(3)A、将Cu片分别放入FeSO4溶液和AgNO3溶液中,Cu与FeSO4溶液不反应,说明了金属的活动性是:Fe>Cu,Cu与AgNO3溶液能反应置换出银,说明了金属的活动性是:Cu>Ag,能比较三种金属的活动性强弱,故A正确;
B、将Fe片分别放入CuSO4溶液和AgNO3溶液中,将铜、银都能置换出来,说明了铁的活动性大于铜、银,但不能比较铜、银的活动性强弱,故B错误;
C、将Cu片、Fe片分别放入稀HCl中,铁能反应,铜不能反应,说明了铁的活动性大于铜;再将Cu片放入AgNO3溶液中,铜能将银置换出来,说明了铜的活动性大于银,能比较三种金属的活动性强弱,故C正确.
故答为:(1)导电性;(2)Fe,Fe+2HCl═FeCl2+H2↑;(3)AC.
点评 金属的活动性顺序是近几年中考的重点之一,经常出现在选择题、填空题和实验题中.本考点考查了学生的实验设计能力、分析能力和实验评价能力,希望同学们认真把握.


科目:初中化学 来源: 题型:解答题
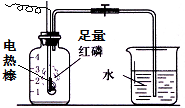 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
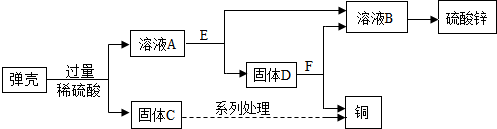
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 解:68g过氧化氢中氧元素的质量为:68g×$\frac{20}{{H}_{2}{O}_{2}}$×100%=68g×$\frac{32}{34}$=64g,因为 氧气中的氧元素来自于过氧化氢,所以68g过氧化氢产生氧气的质量为64g. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com