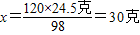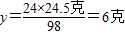将足量镁粉投入到200克12.25%的稀硫酸中,完全反应后,滤出剩余的镁粉,得到滤液.
试计算:
(1)生成硫酸镁的质量为多少克?
(2)滤液的溶质质量分数为多少?
(3)在一定温度下,硫酸镁的溶解度为40克.若要将上述滤液变为该温度下的饱和溶液,需加入硫酸镁多少克?
【答案】
分析:根据镁粉与稀硫酸反应的生成物、反应条件写出化学反应方程式,然后由化学反应方程式计算出生成硫酸镁的质量,以及氢气的质量;再由质量守恒定律求得硫酸镁溶液的质量,从而知滤液的溶质质量分数;最后由溶解度=

100可求得需加入硫酸镁的质量.
解答:解:纯H
2SO
4的质量为:200克×12.25%=24.5克
设生成MgSO
4的质量为x,参加反应Mg的质量为y,生成H
2的质量为z
Mg+H
2SO
4═MgSO
4+H
2↑
24 98 120 2
y 24.5克 x z
(1)98:120=24.5克:x
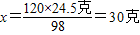
(2)24:98=y:24.5克
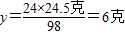
98:2=24.5克:z

滤液的溶质质量分数:

=14.6%
(3)设需加入硫酸镁的质量为m.则

解得:m=40.2克
答:(1)生成硫酸镁的质量为30克;
(2)滤液的溶质质量分数为14.6%;
(3)在一定温度下,硫酸镁的溶解度为40克.若要将上述滤液变为该温度下的饱和溶液,需加入硫酸镁40.2克.
点评:在溶液中进行的化学反应,进行有关计算时应注意:求反应后所得溶液中溶质的质量分数时,溶质质量可由化学方程式的计算直接求得.

 100可求得需加入硫酸镁的质量.
100可求得需加入硫酸镁的质量.