
【题目】“绿水青山就是金山银山”,生活实际中经常要处理工厂排放的废水,中和反应应用广泛。
(1)某同学将氢氧化钠固体放入盛有稀硫酸的试管中并振荡,试管壁发烫,得出中和反应放热。但该结论不合理,理由是___________ 。
(2)改进实验:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,烧杯内溶液温度变化如图1:
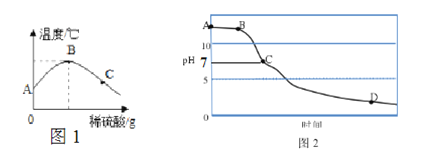
①由图1可知,中和反应是 ______(填“放热”或“吸热”)反应,图1中B点表示的含义是_________。
②用pH传感器测得烧杯中溶液的pH随滴加液体与时间的变化曲线如图2,图中B、C、D所对应溶液中所含溶质硫酸钠的质量大小关系有 ______________。
(3)若一定体积的废水中含有0.01mol氢氧化钠,中和这些碱,需要________mol的硫酸?(例式计算)
(4)而将稀硫酸滴入氢氧化钠溶液中,有气泡产生,可能是氢氧化钠溶液已变质。分析变质的原因_______________________________(用化学方程式表示)。
【答案】 NaOH固体溶于水也放热 放热 恰好反应(合理答案即可) D=C>B 0.025mol 2NaOH+CO2=Na2CO3+H2O
【解析】(1)将氢氧化钠固体放入盛有稀硫酸的试管中并振荡,试管壁发烫,得出中和反应放热。但该结论不合理,理由是NaOH固体溶于水也放热。(2)改进实验:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中。①由图1可知,温度升高,中和反应是放热;图1中B点表示的含义是恰好反应。②用pH传感器测得烧杯中溶液的pH随滴加液体与时间的变化曲线如图2,pH=7时,稀硫酸与氢氧化钠溶液恰好完全反应,pH>7时,氢氧化钠溶液过量,pH<7时,硫酸过量,图中B、C、D所对应溶液中所含溶质硫酸钠的质量大小关系有D=C>B。(3)若一定体积的废水中含有0.01mol氢氧化钠,中和这些碱,2NaOH+H2SO4=Na2SO4 +2H2O,需要0.025 mol的硫酸。2NaOH+H2SO4=Na2SO4 +2H2O
2 1
0.05mol x
![]() =
=![]() ,x=0.025 mol。
,x=0.025 mol。
(4)而将稀硫酸滴入氢氧化钠溶液中,有气泡产生,可能是氢氧化钠溶液已变质。分析变质的原因是2NaOH+CO2 =Na2CO3+H2O。
点睛∶中和反应是放热反应。氢氧化钠溶液在空气中与二氧化碳反应生成碳酸钠。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】小明用蜡烛进行了下列活动。
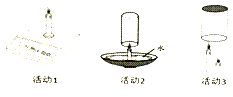
(1)活动1:点燃蜡烛后,电子秤示数逐渐减小。蜡烛减小的质量_____(填“大于”“等于”或“小于”)燃烧后生成物的总质量。
(2)活动2:用玻璃杯扣住燃烧的蜡烛,并使杯口始终浸没在水中。下列说法正确的是_____(填序号)
A.可观察到蜡烛熄灭 B.最终杯中液面高于碗中液面
C.该方法能准确侧测定空气中氧气的含量 D.蜡烛不会熄灭。
(3)活动3:把玻璃杯扣住高低两只燃烧的蜡烛,现象是_____(填序号)
A.两只蜡烛同时熄灭 B.高的蜡烛先熄灭 C.低的蜡烛先熄灭 D.蜡烛不会熄灭
产生该现象的原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】起亚汽车出没在响水的大街小巷,而汽车制造是盐城市的支柱经济产业之一,汽车制造过程中要用到大量的铁、铜、铝等金属材料,请根据所学知识按要求答题
(1)钢铁车壳表面喷漆不仅美观,而且可有效防止与空气中的氧气和_____(填物质名称)接触而生锈
(2)铝的活动性比较强,但在生活中常在铁的表面涂上铝粉,其原因是_____
(3)小王同学从起亚汽车厂整理处一包铜和另一种金属X的混合物(X可能是Ag或Fe),取少量混合物加入足量的稀硫酸有气泡产生,则X不可能是_____.另取一定量的原混合物投入到一定量的AgNO3溶液中,充分反应后,得到固体和溶液,则所得溶液中一定含有的溶质是_____(填化学式)
(4)为测定某汽车厂Cu﹣Zn合金中铜的质量分数,某同学将10g该合金放入到盛有40g足量稀硫酸的烧杯中,充分反应后,测得烧杯中剩余物的质量为49.9g,计算原合金中铜的质量分数是__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H、I都是初中化学学过的物质。其中E、F、H均为黑色固体,B为紫红色固体单质,D为混合物。他们之间有下图的转化关系(部分生成物已省去)
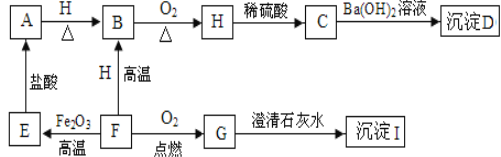
(1)用化学式表示D的组成:___________________
(2)F→G的反应类型 ______________________
(3)写出F→E的化学方程式 __________________________________
(4)指出B的一种用途 _________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水。某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究:
【提出问题】 生成物中有哪几种碳的氧化物?
【猜想】
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有________ | 含有CO和CO2 |
【设计实验】 基于猜想3,依据CO和CO2的性质,兴趣小组同学设计了如下实验:
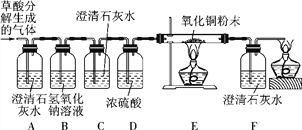
【实验探究】
(1) 观察到________(填序号)装置中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成。
(2) 有两种实验现象都能分别证明草酸分解的气体中含有CO:
① C装置中澄清石灰水不变浑浊,F装置中___________________________;
② E装置中出现_____________________________________的现象。
【实验结论】 通过实验探究证明:猜想3成立。
草酸分解的化学方程式是____________________________________________。
【问题讨论】
(1) B装置的作用是________________________;D装置的作用是__________________。
(2) 装置末端酒精灯的作用是________________________________。
(3)对装置E中玻璃管内的产物成分探究
【查阅资料】
Ⅰ. 一氧化碳还原氧化铜。除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ. Cu2O为不溶于水的红色固体;
Ⅲ. Cu2O+H2SO4===CuSO4+Cu+H2O。
【提出问题】 红色固体含有什么物质?
【猜想假设】
假设一:红色固体只含Cu。
假设二:红色固体只含Cu2O。
假设三:________________________。
【实验验证】 该小组为验证上述假设,取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解。
【实验结论】 根据上述实验结果,可知红色固体中一定含有________。
【数据处理】 为进一步确定红色固体的成分,甲、乙两同学分别称取各自实验后的一定质量的红色固体,加到足量稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体质量如表,请完善表中内容。
实验 人员 | 红色 固体/g | 剩余红色 固体/g | 实验结论 |
甲 | 7.2 | 3.2 | ① __________________ |
乙 | 4.08 | 2.48 | ② __________________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学对碳酸钙高温加热一段时间剩余固体的成分进行探究。
(1)写出高温分解的化学方程式________________。
(2)取反应后的少量固体于试管中,加适量水振荡,静置,有不溶物出现,过滤。
(3)向滤渣中滴加过量稀盐酸,有气泡。固体中一定含有_______。
(4)某兴趣小组用图1装置进行实验时发现:烧杯中饱和石灰水未变浑浊,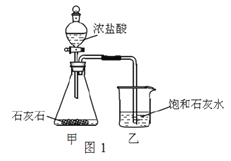
①写出甲装置中发生反应的化学方程式_________________________。
②为探究“饱和石灰水未变浑浊的原因”,开展了如下活动:
分析原因: 可能是澄清石灰水已变质; 也可能是生成的气体中除了有CO2外,还有____________;
实验探究: 将生成的气体X通入图2装置。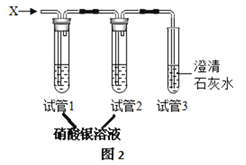
装置 | 试管1 | 试管2 | 试管3 |
现象 | _________ | 无明显变化 | 白色沉淀 |
试管3中发生的化学方程式为_______________;试管2中试剂的作用是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活密切相关。
Ⅰ.在“①稀硫酸、②水、③熟石灰、④酒精、⑤氯化钾、⑥铁粉”中,请选择适当物质的序号填空:
(1)用于改良酸性土壤的是____________, (2)用于清除铁锈的是_________,
(3)实验室常用的液体燃料是____________, (4)最常见的溶剂____________,
(5)用于防止食物变质的双吸剂____________, (6)可作钾肥的是____________。
Ⅱ.合现有下列五种物质A. 食盐 B. 小苏打 C. 苹果 D. 葡萄糖 E. 维生素A
请按下列要求填空(填序号)。
富含维生素C的是___________;可直接进入血液,补充能量的是________;既可作为疏松剂,又可治疗胃酸过多的是________;食用过多会引起血压升高的________;夜盲症患者可以在医生的指导下补充大量________进行治疗。
Ⅲ.材料是人类生产和生活的物质基础,合理使用材料可以改善我们的生活。
(1)钢铁的生产与使用是人类文明和生活进步的一个重要标志。
①工业上用赤铁矿炼铁的主要化学反应方程式:_______________________________,实验室完成此实验是要注意先____________再___________,目的是为了_____________ 。
②我们还可以采用湿法冶金获得金属,请写出铁与硫酸铜溶液反应的化学方程式: ______________。
③ 炒过菜的铁锅未及时洗净擦干,第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是铁与_______和_______反应造成,铁锈的主要成分是________。为防止铁制品锈蚀,可采取的方法有_____________(只需填写一种即可)。
(2) 体育场馆建设需大量建筑材料。下列材料属于复合材料的是________(填字母) ,属于合成材料的是________(填字母)。
a. 石灰石 b. 玻璃钢 c. 玻璃 d 钢筋混凝土 e 聚氯乙烯塑料
Ⅳ.化学的发展为人类解决能源危机带来了曙光。
(1)化学电池是一种高效利用能源的装置,电池在使用时将_______能转化为_______能
(2)下图是某电池的内部结构示意图,
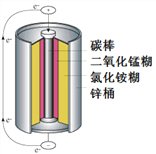
①其中正极为_______,负极为_______。
②请写出用二氧化锰和双氧水混合制取氧气的化学方程式__________________。
③电池材料中的糊状电解质中含有淀粉,我们可以用________(填试剂名称)来检验,检验时课观察到__________________。
④电解液中的氯化铵,再农业生产中可做______肥,施用时要注意__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表,请你分析并进行有关计算:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
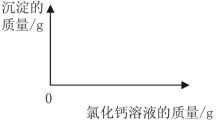
(1)样品中碳酸钠的质量分数是多少?(结果精确到0.1%)
(2)在下图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】家庭中长期使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。小明同学想通过实验测定水垢中碳酸钙的含量,他将过量的稀盐酸加入到200 g水垢中(假定水垢中杂质不与酸反应),并将产生的CO2气体全部通入到足量的NaOH溶液中(不考虑盐酸的挥发性),NaOH溶液增加的质量与反应时间的关系如图所示,
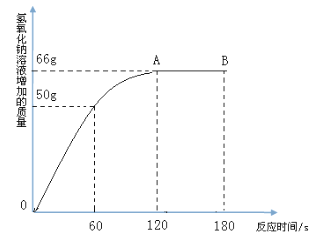
试根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的一项明显现象是_______________。
(2)计算水垢中碳酸钙的质量分数是___________________(写出相应的计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com