
科目:初中化学 来源: 题型:解答题
| 测定时刻 | 6:05 | 6:10 | 6:15 | 6:20 | 6:25 | 6:30 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 纯碱是一种重要的化工基本原料,工业纯碱中往往会含有少量氯化钠杂质.为测定工业纯碱中碳酸钠的质量分数,某学生设计了如图所示的实验装置:
纯碱是一种重要的化工基本原料,工业纯碱中往往会含有少量氯化钠杂质.为测定工业纯碱中碳酸钠的质量分数,某学生设计了如图所示的实验装置:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 第一次 | 第二次 | |
| 加入稀硫酸的质量 | mg | mg |
| 滴加氢氧化钠溶液的质量 | 60g | 100g |
| 滴加硫酸铜溶液的质量 | 40g | 40g |
| 实验现象 | 无明显现象 | 产生蓝色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
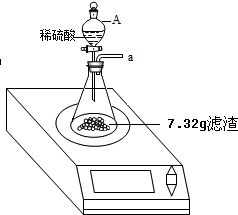 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com