水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
(1)用空塑料饮料瓶、带导管的单孔胶塞、蓬松棉、纱布、活性炭、小卵石、石英沙等材料可自制一个简易净水器.则:认为上述简易净水器
不可以
不可以
(填“可以”或“不可以”)将海水淡化或硬水变成软水.
(2)经检测某工厂排放的废水中含有硫酸铜,过量的硫酸铜会对水体造成严重的污染,人饮用此水会中毒,中毒的原因是
硫酸铜中的铜离子是重金属离子,有毒
硫酸铜中的铜离子是重金属离子,有毒
.请提出一条净化该废水的方法(用化学方程式表示)
CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4
CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4
.
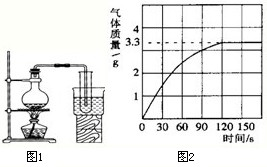
(3)实验室为了配制溶液;常用如图1所示的右边敞口的装置将自来水制取成净化程度较高的蒸馏水(使用的烧瓶、导管、试管等仪器均十分洁净,实验操作准确). 经检测发现该蒸馏水中还含有很少量的杂质,含有的杂质可能是
二氧化碳
二氧化碳
,为什么含有该杂质,试分析原因
二氧化碳能溶于水
二氧化碳能溶于水
,烧杯中水的作用是
降温
降温
.
(4)电解水时,为了增加水的导电性在水中加些稀NaOH溶液,现在通电分解含5% NaOH 的水90g一会儿就停止,经测定此时含10% NaOH,则被分解的水质量为
47.4
47.4
g,产生氧气
42.1
42.1
g,此时水用作
反应物
反应物
.
(5)某校化学兴趣小组同学为了测定某纯碱样品中碳酸钠的含量,将足量质量分数为10%的盐酸加入到10g纯碱中,产生CO
2气体的情况如图2所示(纯碱样品中的杂质不与盐酸反应).
①从图中可以看出,10g纯碱样品与盐酸反应后生成的二氧化碳最多是
3.3
3.3
g.
②纯碱中碳酸钠的分数质量是
79.5%
79.5%
.
③欲使盐酸与该纯碱样品恰好完全反应,则需盐酸的质量为
54.75
54.75
g,盐酸中水用做
溶剂
溶剂
.
④你对“可以通过加水稀释使10%的盐酸变成5%,也可以通过加加热蒸发使10%的盐酸变成20%”的评价是
加热蒸发则氯化氢会加快挥发,使溶液变稀
加热蒸发则氯化氢会加快挥发,使溶液变稀
.




 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.