
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 甲烷 | D. | 臭氧 |
科目:初中化学 来源: 题型:实验探究题
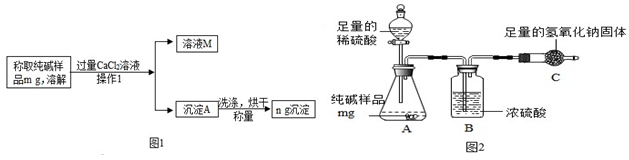
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将生石灰与水反应可加热食物 | |
| B. | 高压锅做饭熟得快是利用了压强增大,沸点降低的原理 | |
| C. | 雾霾天专用口罩中有活性炭,它能吸附有害气体 | |
| D. | 利用液氮和液氧的沸点不同,可将氮气和氧气分离 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | D. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
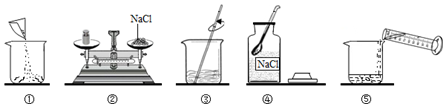
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
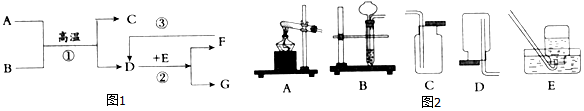
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com