

分析 根据氢氧化钠的性质解答;根据质量守恒定律化学反应前后原子的种类和个数不变解答;根据物质的制取以及溶液的配制的知识解答;根据化学反应方程式结合提供的数据进行分析解答即可.
解答 解:(1)氢氧化钠固体曝露在空气中,容易吸水潮解,能与二氧化碳反应生成碳酸钠而变质,故必须密封保存,故填:潮解;与二氧化碳反应.
(2)根据反应的化学方程式为:SiO2+2NaOH═X+H2O.反应前含有1个Si原子,4个O原子,2个Na原子,2个H原子,反应后含有2个H原子,1个O原子,故X中含有2个Na原子,1个Si原子,3个O原子,故X的化学式为Na2SiO3.故填:Na2SiO3;
(3)①操作Ⅰ是溶解,故填:溶解.
②海水晒盐与蒸发的原理相同,故填:A.
③根据图示可以看出,装置B的作用是过滤,故填:过滤.
(4)称取8.0gNaOH固体,配成20%的溶液,则溶液的质量为:8.0g÷20%=40g,故水的质量为:40g-8.0g=32.0g,故需量取32.0ml蒸馏水,故填:32.0;
【提出疑问】设生成碳酸钠的质量为x,此时通入二氧化碳的质量为a,则有:
2NaOH-CO2-Na2CO3
80 44 106
8g a x
$\frac{80}{106}=\frac{8g}{x}$
x=10.6g
$\frac{80}{44}=\frac{8g}{a}$ a=4.4g
故填:10.6;
【查阅资料】向Na2CO3溶液中通入CO2则碳酸钠、水和二氧化碳会反应生成NaHCO3,故填:Na2CO3+H2O+CO2═2NaHCO3.
【讨论计算】得到的固体的质量为13.7g,设通入的二氧化碳的质量为y
Na2CO3+H2O+CO2═2NaHCO3
106 44 168
$\frac{106y}{44}$ y $\frac{168y}{44}$
(10.6g-$\frac{106y}{44}$)+$\frac{168y}{44}$=13.7g
y=2.2g,
故Na2CO3的质量为10.6g-$\frac{106y}{44}$=5.3g;NaHCO3的质量为$\frac{168y}{44}$=8.4g;通入CO2的质量为(4.4g+2.2g)=6.6g.故填:5.3;8.4;6.6.
点评 本题考查的是常见的碱的性质以及根据化学方程式的计算的知识,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:选择题
| A. | 溶液中的溶剂一定是水 | |
| B. | 酸、碱中一定都含有氧元素 | |
| C. | 生成盐和水的反应一定是中和反应 | |
| D. | 与熟石灰混合研磨后产生氨味的化肥一定是铵态氮肥 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2% | B. | 4% | C. | 10% | D. | 19.6% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
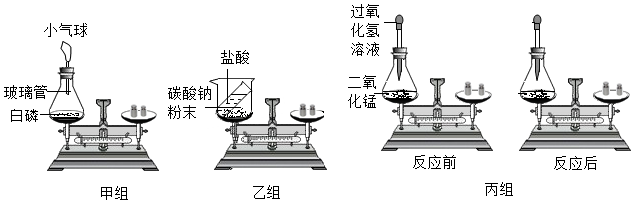
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
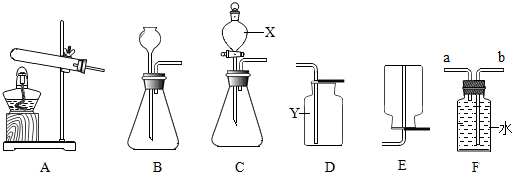
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 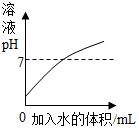 向稀盐酸中不断加水 | |
| B. |  向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 | |
| C. |  分别向等质量的铁、锌中滴加稀盐酸 | |
| D. | 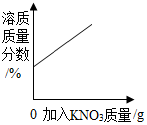 20℃时,向一定量的接近饱和的硝酸钾溶液中加入硝酸钾固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 为测定AgNO3溶液中溶质的质量分数,某同学取一定质量的NaCl溶液,向其中加入200g AgNO3溶液,生成沉淀的质量与所加AgNO3溶液的质量关系如图所示.
为测定AgNO3溶液中溶质的质量分数,某同学取一定质量的NaCl溶液,向其中加入200g AgNO3溶液,生成沉淀的质量与所加AgNO3溶液的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
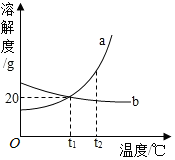 如图是a、b两种物质的溶解度曲线图.根据图中信息判断,下列说法正确的是( )
如图是a、b两种物质的溶解度曲线图.根据图中信息判断,下列说法正确的是( )| A. | a的溶解度大于b的溶解度 | |
| B. | 将t2℃时的a、b两物质的饱和溶液降温到t1℃,都有晶体析出 | |
| C. | t1℃时,a、b的溶解度都为20 g | |
| D. | b物质的不饱和溶液温度升高后一定能变成饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com