
【题目】元素及其化合物知识是化学研究和学习的重要内容。
(1)氯化钠、氯化钙和氯化镁中都含有氯元素,下图是氯在元素周期表中的相关信息,下列说法不正确的是 (填标号)。
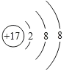

A.该元素属于非金属元素
B.该原子核内质子数为17
C.该元素的原子形成阴离子后,离子结构示意图为
D.该元素的相对原子质量为35.45g
根据生活经验,汗水含有的某物质有咸味,构成该物质的微粒是 (填粒子符号)。
碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,用化学方程式解释其原理
(4)现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生。(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
①该白色粉末中肯定含有什么物质?可能含有什么物质?
②为确定可能含有的物质是否存在,还需要作进一步的实验验证,请写出简要的实验步骤。
食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品20g,加入一定量稀盐酸恰好完全反应,同时产生了6.6g气体。试计算该食用纯碱中碳酸钠的质量分数。(写出计算过程)。
【答案】(1) D (2) Na+、Cl-- (3) 2NaHCO3△Na2CO3 + H2O + CO2↑
(4) ① 肯定含有Na2CO3;可能含有NaOH
② 取少量(I)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH)
(5)79.5%
【解析】
试题分析:(1)A、该元素名称的偏旁部首是“气字头”属于非金属元素,正确,B、该原子核内质子数为17,正确,C、该元素的原子做外层电子数为7,所以容易得到1个电子,形成阴离子,正确,D、该元素的相对原子质量为35.45,单位不是g,正确
(2)汗水含有的某物质有咸味,是由于汗液中含有氯化钠,是由离子构成的,构成该物质的微粒是:Na+、Cl--
(3)碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,是因为碳酸氢钠受热易分解,发生的化学方程式是:2NaHCO3△Na2CO3 + H2O + CO2↑
(4)这是一个实验推断题,应紧紧跟住实验的过程,抓住实验过程中的现象进行分析,实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液,说明一点不含CuSO4,因为CuSO4的水溶液显蓝色,同时BaCl2和Na2CO3不能共存,因为会形成白色沉淀,而实验中没有这个现象,(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生,说明一定含Na2CO3,则一定不含BaCl2
①该白色粉末中肯定含有含有Na2CO3;可能含有NaOH
②要确定NaOH是否存在,检验的实验步骤:取少量(I)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH),不能直接来检验NaOH是否存在,因为Na2CO3的水溶液也呈碱性
(5)根据反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2质量关系,可算出Na2CO3的质量,进而算出食用纯碱中碳酸钠的质量分数
解:设Na2CO3的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 6.6g
106/44=== x/ 6.6g x==15.9 g
碳酸钠的质量分数为:15.9 / 20×100%===79.5%


科目:初中化学 来源: 题型:
【题目】2013年5月,某市自来水有股奇怪的味道,经专家多轮综合检测,基本认定引起此次异味的主要物质是邻叔丁基苯酚。将30克邻叔丁基苯酚完全燃烧,生成88克CO2和25.2克H2O(无其他产物)。已知邻叔丁基苯酚的相对分子质量为150,求:
(1)30克邻叔丁基苯酚中含碳元素 克,氢元素 克。
(2)邻叔丁基苯酚的化学式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(3分)初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由离子构成的物质是
(2) 是某粒子的结构示意图,该粒子在化学反应中容易 电子(填“得到”或“失去”)。
是某粒子的结构示意图,该粒子在化学反应中容易 电子(填“得到”或“失去”)。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是 (填序号)。
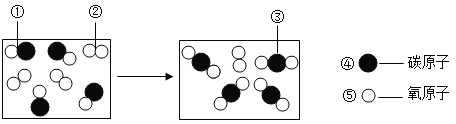
A. ①② B. ②③ C. ③④ D.④⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金。
(1)赤铜(Cu2O)是我国古代制取黄铜的一种原料。Cu2O中铜元素与氧元素的质量比是 。
(2)用来制造弹壳的黄铜只含有锌和铜。将22g弹壳放在盛有100g稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121.8g。计算:
①产生氢气的质量。
②弹壳中铜的质量。
③反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(3分)根据下列微观示意图回答问题:
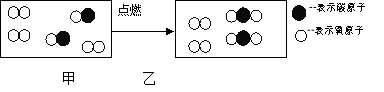
(1)写出该反应的化学方程式。
(2)请从微观角度分析,甲和乙均属于混合物的判断依据是什么?
(3)写出检验生成物的化学方程式。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2014年哈尔滨继续执行“南拓”战略,建设哈南新城,在建设哈南的过程中,下列说法错误的是…………………………………………………………………( )
A.会展中心的建设需要大量的钢筋混凝土属于金属材料
B.积极拓建南城公路可以缓解城区交通压力,提高城区运力
C.哈南环城自行车的推广使用,有利于减少汽车尾气的污染
D.731遗址申遗的工作需要全区人民的积极配合
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(2分)化学是一门以实验为基础的科学,不规范的实验操作会导致测量结果不准确。请从对实验数据影响的角度将下列实验操作平均分成两类。
①量取液体体积时 ②粗盐提纯实验中因蒸干导致 ③测氢氧化钠溶液的pH时 ④测定空气氧气
俯视读数 固体溅出后所计算的产率 先用水润湿试纸 含量时没夹弹簧夹
(1)其中一种分类标准是 ,
(2)包含的操作是 (填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列推理合理的是
A. 因为离子是带电的微粒,所以带电的微粒一定是离子
B. 因为同种分子构成的物质是纯净物,所以纯净物一定是由分子构成的
C. 因为单质中只含一种元素,所以只含一种元素的纯净物一定是单质
D. 因为燃烧需要同时满足三个条件,所以灭火一定要同时控制这三个条件
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(12分)以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
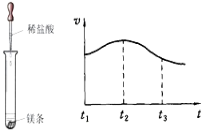
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
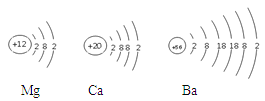
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com