

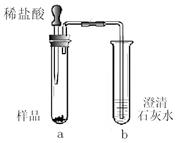
| 实验操作 | 实验现象 | 实验结论 |
| ⑴取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液。 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有 ① 和氢氧化钙。 |
| ⑵另取少量固体放于试管中,滴加足量稀盐酸。 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有 ② , 一定不含Fe2O3。 |
| ⑶将步骤⑵中产生的气体通入到澄清的石灰水中。 | ③ | 固体中一定含有CaCO3。 |



 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
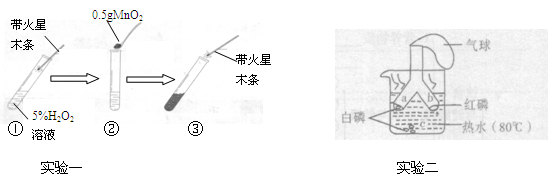
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
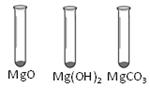
| | MgO | Mg(OH)2 | MgCO3 |
| 消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.小明用木炭代替红磷做测定空气中氧气含量的实验 |
| B.小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性 |
| C.小聪在20℃配制36%的氯化钠溶液(20℃时氯化钠的溶解度为36 g) |
| D.小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 烧杯中可能出现的现象 | 结论 |
| ① | 只含C |
| ②固体部分溶解,溶液变成蓝色,无气泡 | |
| ③有黑色不溶物,有气泡逸出,溶液呈浅绿色 | 含C、Fe |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 结 论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别硬水和软水 | 加肥皂水搅拌 |
| B | 除去氯化钠固体中的少量碳酸钠 | 加入适量稀盐酸,充分反应后,蒸发 |
| C | 分离碳酸钠和氢氧化钠的混合物 | 加入过量氢氧化钙溶液,过滤 |
| D | 探究燃烧的条件之一:温度达到着火点 | 用导管分别对准浸没在热水和冷水中的白磷通氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com