把铁和铜的混合物样品,分成等质量的两份.一份与过量的稀硫酸反应生成氢气0.4g,在另一份中加入足量的硫酸铜溶液,反应后所得不溶性固体质量为21.6g,求:
(1)原混合物样品中铁多少克?
(2)原混合物中铜的质量分数?
解:(1)设生成0.4g氢气消耗铁的质量为x
Fe+H
2SO
4=FeSO
4+H
2↑
56 2
x 0.4g
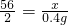
x=11.2g
原混合物样品中铁的质量=11.2g×2=22.4g;
(2)设11.2g铁完全反应置换出铜的质量为y
Fe+CuSO
4=FeSO
4+Cu
56 64
11.2g y
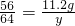
y=12.8g
原混合物样品中铜的质量=(21.6g-12.8g)×2=17.6g
原混合物中铜的质量分数=
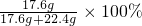
=44%
答:(1)原混合物样品中铁为22.4g;
(2)原混合物中铜的质量分数为44%.
分析:(1)根据金属活动性可知铜不能与稀硫酸反应,则混合物与稀硫酸反应产生的氢气为铁与硫酸反应的结果.根据生成氢气的质量可由反应的化学方程式计算出铁的质量的二倍即为原混合物中铁的质量;
(2)根据金属活动性可知,铁可以与硫酸铜反应置换出铜,因此根据混合物中铁的质量计算出完全反应所置换出铜的质量;反应后所得不溶性固体为原混合物的一半中铜与置换生成铜的质量和,用所得固体质量减去生成铜的质量的二倍即为原混合物中铜.据此可解决原混合物中铜的质量分数问题.
点评:解答时需注意:由于原混合物平均分成两份,因此与过量稀硫酸反应产生氢气的铁的质量为原混合物中铁的质量的一半.

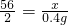
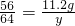
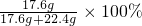 =44%
=44%

 字词句段篇系列答案
字词句段篇系列答案